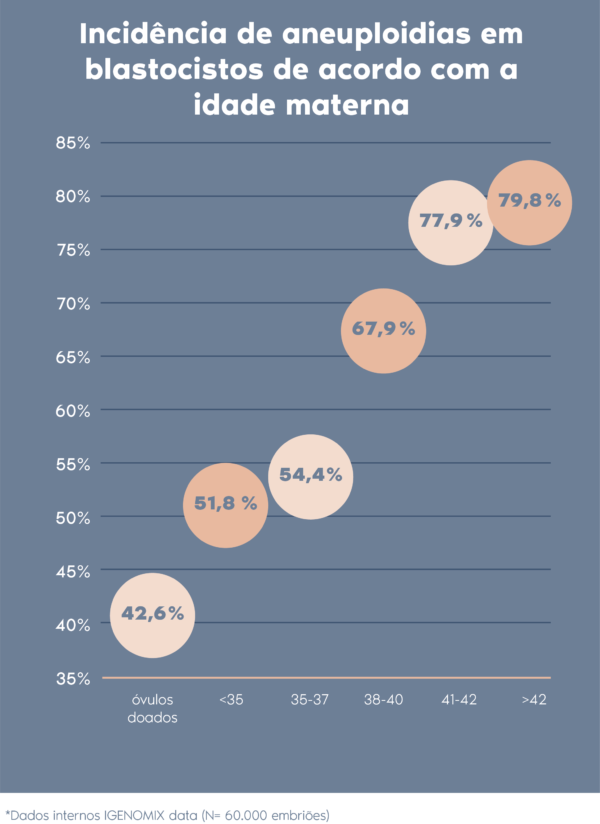
Diante de um resultado de aneuploidia recebido através do teste PGT-A (diagnóstico pré-implantacional) a inviabilidade do embrião está comprovada com uma confiança de mais de 98%. Seja qual for o cromossomo envolvido, não é recomendada a transferência embrionária nos tratamentos de FIV (Fertilização in Vitro)
No entanto, conhecer um pouco mais sobre o cromossomo alterado pode ajudar a lidar com o resultado, lembrando que este conteúdo destina-se para fins de conhecimento e não deve ser entendido como substituto do aconselhamento genético profissional.
O que são cromossomos?
Os cromossomos são as estruturas que mantêm nossos genes, e os genes são as instruções individuais que dizem ao nosso corpo como se desenvolver e se manter saudável. Em todas as células do nosso corpo, existem mais de 20 mil genes, localizados em 46 cromossomos. Normalmente, cada célula do corpo humano possui 46 cromossomos, organizados em 23 pares (22 pares de autossomos, idênticos em homens e mulheres) e um par de cromossomos sexuais − XX em mulheres e XY em homens. Cada cromossomo possui um braço p e q; p (petit) é o braço curto e q (próxima letra do alfabeto) é o braço longo.As aneuploidias perturbam o delicado equilíbrio dos produtos gênicos nas células. Por definição, as células aneuploides têm um número anormal de cromossomos.
A análise cromossômica não detecta alterações em genes
O que são trissomias?
Nos seres humanos, as aneuploidias mais comuns são as trissomias, que representam cerca de 0,3% de todos os nascidos vivos. As trissomias são caracterizadas pela presença de um cromossomo adicional, elevando o número total de cromossomos para 47. Com poucas exceções, as trissomias em geral não são compatíveis com a vida. De fato, elas representam cerca de 35% dos abortos espontâneos e estão presentes, de uma maneira exponencial conforme o aumento da idade manterna nas mulheres. As trissomias viáveis são restritas a apenas alguns cromossomos humanos. A mais comum envolve o cromossomo 21 e é conhecida como síndrome de Down (DS).
O que são monossomias?
As monossomias são o oposto das trissomias, pois os indivíduos afetados perdem um cromossomo, reduzindo seu número total de cromossomos para 45. As células parecem ser particularmente sensíveis à perda de um cromossomo, porque a única monossomia humana viável envolve o cromossomo X. As mulheres com uma única cópia do cromossomo X têm a condição conhecida como síndrome de Turner. Em questões de fertilidade, as monossomias normalmente representam as falhas de implantação presentes após a transferência de embriões não testados geneticamente.
Curiosamente, a frequência da síndrome de Turner é significativamente menor do que a das trissomias dos cromossomos sexuais, sugerindo que um único cromossomo X é insuficiente para a função celular ideal. As mulheres viáveis de Turner (45, X) apresentam várias manifestações clínicas, que incluem infertilidade e baixo desenvolvimento das características sexuais secundárias, e esses indivíduos geralmente têm características melhores quando se apresentam na forma de mosaicos.
O que são embriões mosaico?
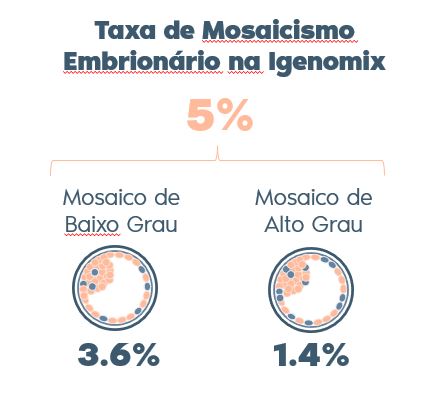
Os embriões mosaico são aqueles que possuem dois ou mais tipos de linhagem celular com diferentes cromossomos no mesmo embrião. O mosaicismo detectado através do PGT-A a partir da biópsia de células do trofectoderma (região do embrião que dará origem à placenta) pode ter implicações clínicas teóricas para o feto, placenta ou ambos, em qualquer gravidez, incluindo efeitos sobre a função placentária, síndromes de doenças nascidas vivas ou ambos, bem como pode gerar uma gravidez e bebê saudável.
Posso transferir embriões mosaico?
https://youtube.com/shorts/Q_ZN_-i2JWM
O que é PGT-A?
PGT-A é o teste genético pré-implantacional para aneuploidias realizado a partir de uma amostra de células coletadas através de uma biópsia de embriões. Enquanto a biópsia embrionária é realizada em uma clínica de Fertilização in Vitro, o PGT-A que avalia o conteúdo cromossômico do embrião é feito em um laboratório de genética, como a Igenomix.
Cromossomo 1
O cromossomo 1 é classificado como metacêntrico e corresponde ao maior dos 23 pares que compõem o genoma humano. Ele possui mais de 3.400 genes e muitas centenas deles estão relacionados ao desenvolvimento e formação de órgãos do corpo.
Monossomia (-1)
A monossomia do cromossomo 1 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+1)
A trissomia do cromossomo 1 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Não existem relatos de nascidos vivos com este tipo de aneuploidia, apenas descrições desta alteração envolvida em abortos precoces. A trissomia 1 foi reportada em gestações naturais com perda após aproximadamente 50 dias de fertilização (Banzai et al., 2004; Ana Vicˇic et al., 2008). Dunn e colaboradores (Dunn et al., 2001) reportaram um caso de trissomia 1 em uma gestação por fertilização in vitro (FIV) em que, apesar de aumento de hCG e ultrassom vaginal detectar saco gestacional, aos 42 dias após a fertilização não foi possível observar batimento cardíaco fetal.
Referências
Banzai et al. (2004). Trisomy 1 in a case of a missed abortion. Journal of human genetics. 49. 396-7. 10.1007/s10038-004-0164-1.
Dunn TM, Grunfeld L, Kardon NB. (2001). Trisomy 1 in a clinically recognized IVF pregnancy. Am J Med Genet 2001;99:152-3.
Vičić A. et al. (2008). Trisomy 1 in an early pregnancy failure. American Journal of Medical Genetics Part A, 146A(18), 2439–2441.
Cromossomo 2
O cromossomo 2 é classificado como metacêntrico e corresponde ao segundo maior dos 23 pares que compõem o genoma humano. Ele contém aproximadamente 1.500 genes, dos quais 200 estão relacionados a diferentes tipos de patologias genéticas.
Monossomia (-2)
A monossomia do cromossomo 2 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB, et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+2)
A trissomia do cromossomo 2 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Esta aneuploidia contribui significativamente para as perdas gestacionais no primeiro trimestre, ocorrendo em 0,16% das gestações clinicamente reconhecidas (Hassold & Jacobs, 1984). Apenas a trissomia 2 em mosaico é observada em nascidos vivos sendo reportados poucos casos apresentando fenótipo variável (Sago et al., 1997; Gupta et al., 2007), caracterizado por restrição de crescimento intra-uterino (RCIU), oligodrâmnio e um espectro de alterações congênitas, incluindo hidronefrose, defeitos cardíacos, defeitos do tubo neural e dismorfismo (Cramer et al., 1993; Pappas et al., 1995; Sago et al., 1997).
Referências
Cramer A et al. (1993). Tissue-specific trisomy 2 mosaicism in an infant with Pfeiffer syndrome-like features. Am J Hum Genet 53:538.
Gupta S et al. (2007). Trisomy 2 mosaicism in hypomelanosis of Ito. Am J Med Genet 143A:2466–2468.
Pappas J et al. (1995). Trisomy 2 mosaicism. Am J Hum Genet 57:A286.
Hassold T., Jacobs P. (1984). Trisomy in Man. Ann Rev Genet 18:392–395.
Sago H et al. (1997). True trisomy 2 mosaicism in amniocytes and newborn liver associated with multiple system abnormalities. Am J Med Genet 72:343–346.
Cromossomo 3
O cromossomo 3 representa mais de 6,5% do DNA total nas células. A identificação de genes em cada cromossomo é uma área ativa de pesquisa genética. O cromossomo 3 provavelmente contém 1.500 genes que fornecem instruções para produzir proteínas que possuem diferentes funções no corpo humano.
Monossomia (-3)
A monossomia do cromossomo 3 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45 e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+3)
A trissomia do cromossomo 3 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. Esta aneuploidia é encontrada em cerca de 0,8% dos casos analisados de abortos espontâneos do primeiro trimestre (Jackson-Cook, 2011). Apenas a trissomia 3 em mosaico foi reportada em nascidos vivos na literatura (Metaxotou et al., 1981; Kuhn et al., 1987; De Keyser et al., 1988; Yang et al., 2016) com algumas manifestações clínicas em comum como baixa estatura e alterações esqueléticas (Yang et al., 2016).
Referências
De Keyser F et al. (1988). Trisomy 3 mosaicism in a patient with Bartter syndrome. J Med Genet 25:358.
Jackson-Cook C. (2011). Constitutional and acquired autosomal aneuploidy. Clin Lab Med 31:481–511.
Kuhn EM, Sarto GE, Bates BJ, Therman E. (1987). Gene-rich chromosome regions and autosomal trisomy. A case of chromosome 3 trisomy mosaicism. Hum Genet 77:214–220.
Metaxotou C et al. (1981). Trisomy 3 mosaicism in a live-born infant. Clin Genet 19:37–40.
Yang Y. et al (2016). Trisomy 3 mosaicism in a 5-year-old boy with multiple anomalies: A very rare case. American Journal of Medical Genetics Part A, 170(6), 1590–1594.
Cromossomo 4
O cromossomo 4 representa mais de 6% do DNA total das células. O cromossomo 4 provavelmente contém de 1.000 a 1.100 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-4)
A monossomia do cromossomo 4 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+4)
A trissomia do cromossomo 4 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Van Allen e colaboradores (Van Allen et al., 1993) reportaram um caso de trissomia 4 em um feto de 18 semanas com ciclopia, holoprosencefalia alobar, cardiopatia congênita complexa, atresia anal, oligosindactilia, higroma cístico e anormalidades esqueléticas.
A trissomia 4 em mosaico é rara em nascidos vivos, pois aproximadamente quatro casos foram confirmados (Marion et al., 1990; Wieczorek et al., 2003; Brady et al., 2005; Lal & Di, 2015). Com base nesses quatro pacientes, o fenótipo comum da trissomia 4 em mosaico parece incluir: restrição de crescimento intrauterino (RCIU) (3/3), baixo peso ao nascer/tamanho/diâmetro occipital-frontal (3/3), defeitos cardíacos congênitos (3/3), anomalias características do polegar (3/3), anormalidades da pele (3/4) e vários dismorfismos faciais (assimetria da face, alterações da sobrancelha, baixa implantação de orelhas, orelhas rotadas posteriormente e micro/retrognatia).
Referências
Brady AN, May KM, Fernhoff PM. (2005). Mosaic trisomy 4: Long-term outcome on the first reported liveborn. Am J Med Genet Part A 132A:411–413.
Lal K, Di Lernia V. (2015). Linear and whorled naevoid hypermelanosis in a patient with trisomy 4 mosaicism. Clin Exp Dermatol 40:45–47.
Marion JP et al. (1990). Pre- and post-natal diagnosis of trisomy 4 mosaicism. Am J Med Genet 37:362–365.
Van Allen, M. I. et al.(1993). Trisomy 4 in a fetus with cyclopia and other anomalies. American Journal of Medical Genetics, 46(2), 193–197.
Wieczorek D et al. (2003). Prenatally detected trisomy 4 and 6 mosaicism-cytogenetic results and clinical phenotype. Prenat Diagn 23:128–133.
Cromossomo 5
O cromossomo 5 representa cerca de 6% do DNA total nas células. O cromossomo 5 tem uma baixa densidade de genes, pois a maioria de suas partes possui regiões gênicas não codificantes.
Monossomia (-5)
A monossomia do cromossomo 5 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com este tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+5)
A trissomia do cromossomo 5 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 5 foi detectada em abortos espontâneos por alguns autores e não é compatível com a vida (Ikeuchi & Sasaki, 1974; Ohama &Kusumi, 1976). Os nascidos vivos são mosaicos com características clínicas inespecíficas e variáveis. Brown relatou, em 2008, um feto com 50% mosaicismo para trissomia 5, diagnosticado por amniocentese. O feto apresentava cardiopatia congênita, terminou em aborto com 21 semanas de gestação e o exame patológico fetal revelou uma aparência facial dismórfica (Brown, 2008). Resultados anormais também foram relatados por Sciorra e colegas (Sciorra et al., 1992) em um nascido vivo com mosaicismo para trissomia 5. No pré-natal foi observada restrição de crescimento intrauterino (RCIU), eventração diafragmática e defeito do septo ventricular (VSD) e, no pós-natal, o paciente apresentava características faciais dismórficas como testa alta, quadrada, hipertelorismo e ponte nasal proeminente (Sciorra et al., 1992).
Referências
Brown, S. (2008). Miscarriage and its associations. Seminars in Reproductive Medicine, 26, 391–400.
Ikeuchi T, Sasaki M. (1974). A spontaneous abortus with trisomy 5 identified by fluorescent techniques. Proc Japan Acad, 1974; 50: 503–6.
Ohama K, Kusumi I. (1976). Trisomy 5 in two abortuses. Jap J Human Genet, 1976; 21: 1–4.
Sciorra, L. J et al. (1992). Trisomy 5 mosaicism detected prenatally with an affected liveborn. Prenatal Diagnosis, 12, 477–482.
Cromossomo 6
O cromossomo 6 é metacêntrico e representa cerca de 6% do DNA total nas células. O cromossomo 6 provavelmente contém cerca de 1.500 genes que fornecem instruções para a produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-6)
A monossomia do cromossomo 6 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com este tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+6)
A trissomia do cromossomo 6 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). A detecção pré-natal da trissomia 6 é um achado raro, com todos os casos sendo mosaico (Gupta et al., 2004). Destrée e colegas (Destrée et al., 2005) relataram um feto com múltiplas anomalias congênitas detectadas no exame pré-natal de ultrassom e trissomia 6 em mosaico nos amniócitos. A gravidez foi interrompida na 18ª semana gestacional e a autópsia revelou malformações, incluindo mão direita em fenda, artrogripose e hipoplasia do quarto dígito da mão esquerda, sindactilias e dedos dos pés sobrepostos, dismorfismo facial com hipertelorismo e orelhas baixas, defeito do septo ventricular (VSD), má rotação intestinal e escoliose. A trissomia 6 em mosaico foi detectada em amniócitos cultivados (13,3%), em fibroblastos do cordão umbilical (40%) e por hibridação fluorescente in situ em outros tecidos fetais. Wegner e colaboradores (Wegner et al., 2004) também reportaram um caso de trissomia 6 em mosaico. A análise pré-natal indicou translucência nucal aumentada e cardiopatia e além das anomalias detectadas no pré-natal, o recém-nascido apresentava mamilo acessório, anomalias das extremidades, incluindo sindactilia e mão em fenda.
Referências
Hassold T et al. (1980). Cytogenetic study of 1,000 spontaneous abortions. Ann Hum Genet 44:151–178.
Wegner et al. (2004). Prenatal Diagnosis of Fetal Trisomy 6 Mosaicism and Phenotype of the Affected Newborn. American journal of medical genetics. Part A. 124A. 85-8. 10.1002/ajmg.a.20407.
Cromossomo 7
O cromossomo 7 representa mais de 5% do DNA total nas células. O cromossomo 7 provavelmente contém de 900 a 1.000 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-7)
A monossomia do cromossomo 7 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+7)
A trissomia do cromossomo 7 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 7 é responsável por 4 a 10% de todas as trissomias (Warburton et al., 1980). Ela é rara e considerada letal na embriogênese, pois nunca foi observada em nascidos vivos. As características patológicas até agora descritas na trissomia 7 variam de sacos gestacionais vazios com vilosidades, feto com fenda palatina, aorta do lado direito, má rotação de intestino, rins pequenos e cordão umbilical apenas com uma artéria (Warburton et al., 1991). De acordo com Furau (Furau et al., 2016), os nascidos vivos são mosaicos com características clínicas inespecíficas e variáveis.
Referências
Warburton D, Byrne J, Canki N (1991). Chromosomal Anomalies and Prenatal Development: An Atlas. New York. Oxford University Press.
Warburton D, Stein Z, Klijne J, Susser M. (1980). Chromosome abnormalities in spontaneous abortion. In: Potte IH, Hook EB eds. Human Embryonic and Fetal Death. New York: Academic Press, 1980: 261–88
Furau, Cristian. (2016). Mosaic trisomy 7. Archives of the Balkan Medical Union. 51. 261-266.
Cromossomo 8
O cromossomo 8 representa mais de 5% do DNA total nas células. O cromossomo 8 provavelmente contém aproximadamente 700 genes que fornecem instruções para a produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-8)
A monossomia do cromossomo 8 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+8)
A trissomia do cromossomo 8 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 8 é letal e responde por 0,7% a 0,8% dos abortos espontâneos (Campbell et al., 2001). Apenas a trissomia 8 em mosaico, também conhecida como síndrome de Warkany, é observada em nascimentos e tem uma frequência estimada de 1: 25.000 a 1: 50.000 (Jordan et al., 1998; Wisniewska & Mazurek, 2002). De acordo com Jordan e colaboradores (Jordan et al., 1998) e Wisniewska e Mazurek (Wisniewska & Mazurek, 2002), as alterações descritas associadas com a trissomia 8 em mosaico incluem atraso mental moderado, agenesia do corpo caloso, defeitos cardíacos congênitos, alterações renais, patelas hipoplásicas ou ausentes, camptodactilia, deformidade da coluna vertebral, limitação do movimento de articulação, testa proeminente, palato alto e arqueado etc.
Referências
Campbell S et al. (2001). Prenatal diagnosis of mosaic trisomy 8 in a fetus with normal nuchal translucency thickness and reversed end-diastolic ductus venosus flow. Ultrasound Obstet Gynecol. 17(4): 341-3.
Jordan MA et al. (1998). Trisomy 8 mosaicism: a further five cases illustrating marked clinical and cytogenetic variability. Genet Couns. 9:139e46.
Wisniewska M, Mazurek M (2002). Trisomy 8 mosaicism syndrome. J Appl Genet. 43:115e8.
Cromossomo 9
O cromossomo 9 representa 4.5% do DNA total nas células. O cromossomo 9 provavelmente contém aproximadamente de 800 a 900 genes que fornecem instruções para a produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-9)
A monossomia do cromossomo 9 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+9)
A trissomia do cromossomo 9 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 9 é um distúrbio cromossômico raro em recém-nascidos vivos e responde por 2,4% dos abortos espontâneos (Stoll et al., 1993). A sobrevida média dos pacientes com trissomia 9 é de 20 dias (Wooldridge & Zunich, 1995). Alguns casos de trissomia 9 em mosaico, embora com uma baixa proporção de células trissômicas nos linfócitos, sobrevivem até o fim da infância (Okumura et al., 2000). As principais características da síndrome da trissomia 9 são nariz “bulboso”, microftalmia, membros deslocados e outras alterações do sistema esquelético, cardíaco, geniturinário e nervoso central (SNC). As malformações esqueléticas relatadas nesse distúrbio incluem luxação congênita do quadril, deformidade em calcâneo-valgo, hiperflexação articular, escoliose e cifose (Arnold et al., 1995).
Referências
Arnold G.L. et al. (1995). Trisomy 9: review and report of two new cases. Am J Med Genet. 56:252–7.
Okumura A. et al. (2000). Two patients with trisomy 9 mosaicism. Pediatr Int. 42:89–91.
Stoll C. et al. (1993). Trisomy 9 mosaicism in two girls with multiple congenital malformations and mental retardation. J Med Genet. 30:433–5. doi: 10.1136/jmg.30.5.433.
Wooldridge J, Zunich J. (1995). Trisomy 9 syndrome: report of a case with Crohn disease and review of the literature. Am J Med Genet. 56:258–64.
Cromossomo 10
O cromossomo 10 representa mais de 4% do DNA total nas células. O cromossomo 10 provavelmente contém de 700 a 800 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-10)
A monossomia do cromossomo 10 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+10)
A trissomia do cromossomo 10 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Essa aneuploidia foi identificada em 1,8% dos abortos (Byrne et al., 1985; Boue et al., 1975) e é dependente da idade materna (Hassold et al., 1984). Enquanto nenhum dos fetos diagnosticado com trissomia 10 sobreviveram a termo, todos os casos de trissomia 10 em nascidos vivos foi encontrado como mosaico com uma linha celular euplóide (De France et al., 1985; Boon et al., 1996) ou monossomia X (Mielke et al., 1997). De acordo com Hahnemann e colegas (Hahnemann et al., 2005), existem apenas 7 nascimentos relatados de crianças com esta aneuploidia. Desses 7, apenas 1 caso pré-natal (relatado em 2001) foi considerado como um trissomia completa do cromossomo 10; no entanto, às 35 semanas + 4 dias de gestação, a gestante foi submetida a parto prematuro com consequente morte intra-uterina (Brizot et al., 2001). Os outros 6 casos de nascidos vivos foram descritos com trissomia 10 em mosaico, com características clínicas típicas, incluindo problemas de alimentação, atraso de crescimento, blefarofimose, orelhas baixas, palato alto e arqueado, retrognatia, cardiopatia e morte prematura.
Referências
Boon C. et al. (1996). Partial trisomy 10 mosaicism with cutaneous manifestations: report of a case and review of the literature. Clin Genet. 50: 417–21.
Boue J. et al. (1975). Identification of C trisomies in human abortuses. J Med Genet.12:265–8.
Brizot M.L. et al. (2001). Trisomy 10: ultrasound features and natural history after first trimester diagnosis. Prenat Diagn. Aug;21(8):672–5.
Byrne J. et al. (1985). Morphology of early fetal deaths and their chromosomal characteristics. Teratology.32:297–315.
De France H.F. et al. (1985). Trisomy 10 mosaicism in a newborn boy; delineation of the syndrome. Clin Genet. 27:92–6.
Hahnemann J.M. et al. (2005). Trisomy 10 mosaicism and maternal uniparental disomy 10 in a liveborn infant with severe congenital malformations. Am J Med Genet A. 138A(2):150–4.
Hassold T. et al. (1984). The relationship of maternal age and trisomy among trisomic spontaneous abortions. Am J Hum Genet. 36:1349–56.
Mielke G. et al. (1997). Prenatal detection of double aneuploidy trisomy 10/monosomy X in a liveborn twin with exclusively monosomy X in blood. Clin Genet. 51:275–7.
Cromossomo 11
O cromossomo 11 representa de 4 a 4.5% do DNA total nas células. O cromossomo 11 provavelmente contém de 1.300 a 1.400 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-11)
A monossomia do cromossomo 11 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com este tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+11)
A trissomia do cromossomo 11 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 11 é rara e reportada em casos de abortos espontâneos (Balasubramanian et al., 2011). Os casos de mosaicismo também parecem ser letais; Wilmot e colaboradores (Wilmot et al. (1983) relataram um feto acefálico apresentando trissomia do cromossomo 11 em mosaico e Balasubramanian e colegas (Balasubramanian et al., 2010) publicaram um caso de uma gestação interrompida às 21 semanas que mostrou agenesia renal bilateral, fácies de Potter, âmnio nodoso, entre outros.
Referências
Balasubramanian, M. (2011). Mosaic trisomy 11 in a fetus with bilateral renal agenesis. Clinical Dysmorphology, 20(1), 47–49.
Wilmot PL et al. (1983). Trisomy 11: a severely disruptive influence. Am J Hum Genet 35:162ª.
Cromossomo 12
O cromossomo 12 representa de 4 a 4.5% do DNA total nas células. O cromossomo 12 provavelmente contém cerca de 1.200 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-12)
A monossomia do cromossomo 12 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com este tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+12)
A trissomia do cromossomo 12 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 12 também é muito raramente diagnosticada em crianças nascidas vivas; na literatura existem casos em mosaico. O fenótipo clínico da trissomia 12 em mosaico varia e pode incluir baixa estatura, atraso no desenvolvimento neuropsicomotor, displasia pigmentar, cardiopatia congênita, microcefalia, assimetria facial, orelhas proeminentes, hipotonia, retinopatia, perda auditiva neurossensorial, manchas cutâneas e escoliose (Bischoff et al., 1995; Al-Hertani et al., 2012; Chen et al. 2013). Essa alta variação fenotípica pode ser devida a diferenças no número de células analisadas ou à presença concomitante frequente de outros desequilíbrios cromossômicos e dificulta os esforços para delinear um fenótipo específico para a condição (Bischoff et al., 1995; Al-Hertani et al., 2012; Chen et al. ,2013).
Referências
Al-Hertani W et al. (2012). Novel clinical findings in a case of postnatally diagnosed trisomy 12 mosaicism. Am J Med Genet 158A:1452–1454.
Bischoff FZ et al. (1995). Mosaicism for trisomy 12: four cases with varying outcomes. Prenat Diagn 15:1017–1026 (1995).
Chen CP et al. (2013). Mosaic trisomy 12 at amniocentesis: prenatal diagnosis and molecular genetic analysis. Taiwan J Obstet Gynecol 52: 97–105.
Cromossomo 13
O cromossomo 13 representa de 3.5 a 4% do DNA total nas células. O cromossomo 13 provavelmente contém cerca de 400 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-13)
A monossomia do cromossomo 13 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+13)
A trissomia do cromossomo 13 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. Na trissomia 13, conhecida como síndrome de Patau, existem informações de nascidos vivos, porém a sobrevida mediana é de 7 a 10 dias e 90% vive por menos de 1 ano (Wyllie et al., 1994; Peroos et al., 2012). Ela é caracterizada por “defeitos cerebrais, anoftalmia aparente, fenda palatina, vincos através das palmas, polegares em gatilho, polidactilia e hemangiomas capilares” (Patau et al., 1960). A causa da síndrome de Patau se deve mais comumente à não disjunção na meiose, ocorrendo com mais frequência em mães com idade avançada (idade superior a 35) (Wyllie et al., 1994). Outra causa é uma translocação Robertsoniana, que resulta em duas cópias normais do cromossomo 13 e em um braço longo adicional do cromossomo 13 (Wyllie et al., 1994). Outra causa menos comum é o mosaicismo, que resulta em três cópias do cromossomo 13 em algumas células e duas cópias nas outras. O mosaicismo é o resultado de um erro de não disjunção mitótica e não está relacionado à idade materna (Petry et al., 2013).
Referências
Patau K et al (1960). Multiple congenital anomaly caused by an extra autosome. Lancet. Apr 09;1(7128):790-3.
Peroos S et al. (2012). Longevity and Patau syndrome: what determines survival? BMJ Case Rep. 2012 Dec 06.
Petry P et al. (2013). Clinical features and prognosis of a sample of patients with trisomy 13 (Patau syndrome) from Brazil. Am. J. Med. Genet. A. Jun;161A(6):1278-83.
Wyllie JP et al. (1994). Natural history of trisomy 13. Arch. Dis. Child. 1994 Oct;71(4):343-5.
Cromossomo 14
O cromossomo 14 representa de 3 a 3.5% do DNA total nas células. O cromossomo 14 provavelmente contém cerca de 800 a 900 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-14)
A monossomia do cromossomo 14 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+14)
A trissomia do cromossomo 14 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia completa do cromossomo 14 é altamente letal para o embrião em desenvolvimento. Nascidos vivos foram relatados apenas em mosaicismo e apresentavam múltiplas alterações congênitas (Shinawi et al., 2008). As manifestações clínicas mais comuns de pacientes com mosaicismo são atraso de crescimento e psicomotor, características craniofaciais dismórficas como nariz largo, orelhas de implantação baixa ou anormais, micrognatia, fenda ou palato altamente arqueado, pescoço curto, cardiopatia congênita e alterações geniturinárias (Shinawi et al., 2008; Fagerberg et al., 2012). Outras características relatadas são hipertelorismo, assimetria corporal e pigmentação anormal da pele (Lynch et al., 2004; Von Sneidern & Lacassie, 2008).
Referências
Fagerberg CR et al. (2012). Trisomy 14 mosaicism: clinical and cytogenetic findings in an adult. Clin Dysmorphol. 21:45–47.
Lynch MF et al. (2004). Trisomy 14 mosaicism: a case report and review of the literature. J Perinatol 2004, 24:121–123.
Shinawi M et al. (2008).Low-level mosaicism of trisomy 14: phenotypic and molecular characterization. Am J Med Genet A 2008, 146A: 1395–1405. 10.1002/ajmg.a.32287
Von Sneidern E, Lacassie Y. (2008). Is trisomy 14 mosaic a clinically recognizable syndrome?–case report and review. Am J Med Genet A. 146A:1609–1613.
Cromossomo 15
O cromossomo 15 (assim como os cromossomos 13, 14, 21 e 22) é acrocêntrico. Ele representa mais de 3% do DNA total nas células. O cromossomo 15 provavelmente contém de 600 a 700 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-15)
A monossomia do cromossomo 15 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+15)
A trissomia do cromossomo 15 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. As trissomias 15 são frequentemente abortadas no primeiro trimestre de gravidez (Markovic et al., 1996; Bennett et al., 1992). A forma em mosaico foi relatada em poucos nascidos vivos e em alguns fetos. De acordo com Knauer-Fischer e colegas (Knauer-Fischer et al., 2004), todos os casos relatados de trissomia 15 em mosaico apresentavam algumas das seguintes características: cardiopatias congênitas, dismorfismos faciais (por exemplo, nariz pequeno com narinas antevertidas, epicanto, ponte nasal larga, testa alta, micrognatia, boca pequena e palato alto e arqueado), anomalias esqueléticas (esterno curto, dedos dos pés e mãos sobrepostos, número anormal de costelas).
Referências
Bennett CP, Davis T, Seller MJ (1992). Trisomy 15 mosaicism in an IVF fetus. J Med Genet 29:745–746.
Knauer-Fischer SA et al. (2004). Mosaic trisomy 15 in a short girl with hemihypotrophy and mental retardation. Clinical Dysmorphology, 13(3), 183–186.
Markovic VD et al. (1996). Trisomy 15 mosaic derived from trisomic conceptus: report of a case and a review. Am J Med Genet 61:363–370.
Cromossomo 16
O cromossomo 16 representa aproximadamente 3% do DNA total nas células. O cromossomo 16 provavelmente contém de 800 a 900 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-16)
A monossomia do cromossomo 16 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen O B et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot N J. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+16)
A trissomia do cromossomo 16 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Ela é responsável por 1-2% ou mais de todos os abortos no primeiro trimestre (Neiswanger et al., 2006). Embora a maioria dos embriões com a trissomia 16 seja abortada espontaneamente ou desenvolvimento interrompido entre 8 e 15 semanas de gestação, alguns embriões sobrevivem e são candidatos ao diagnóstico pré-natal (Benn, 1998). Esses embriões sobreviventes são quase sempre mosaicos (ou seja, contêm linhagens celulares euplóides e trissômicas). A trissomia 16 em mosaico está associada a um alto risco de resultados anormais, como atraso do crescimento intra-uterino (RCIU), morte fetal no útero, pré-eclâmpsia, parto prematuro, morte neonatal, atraso no desenvolvimento, defeitos cardíacos congênitos e outras anomalias menores (Chareonsirisuthigul et al., 2014).
Referências
Chareonsirisuthigul T et al. (2014). Intrauterine growth retardation fetus with trisomy 16 mosaicis. Case Rep Genet. 2014:739513.
Neiswanger K et al. (2006). Variable outcomes in mosaic trisomy 16: five case reports and literature analysis. Prenatal Diagnosis, 26(5), 454–461.
Cromossomo 17
O cromossomo 17 representa mais de 3% do DNA total nas células. O cromossomo 17 provavelmente contém de 1.100 a 1.200 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-17)
A monossomia do cromossomo 17 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+17)
A trissomia do cromossomo 17 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 17 nunca foi observada em bebês e raramente em abortos espontâneos (Hassold & Jacobs, 1984). Shaffer e colegas (Shaffer et al., 1996) reportaram um caso de trissomia 17 em mosaico em uma criança que apresentava atraso mental, convulsões, déficit de atenção por hiperatividade e distúrbios de espectro autista, perda auditiva, atraso de crescimento e microcefalia. Embora o cariótipo a partir de sangue periférico fosse normal, a análise a partir de fibroblastos revelou trissomia 17. Baltensperger e colaboradores (Baltensperger et al., 2016) observaram em um recém-nascido algumas características em comum da trissomia 17 em mosaico com outros casos da literatura, como, por exemplo, microcefalia, baixa estatura, dismorfismos faciais etc.
Referências
Baltensperger, A., Haischer, G., & Rohena, L. (2016). Rare case of live born with confirmed mosaic trisomy 17 and review of the literature. Clinical Case Reports, 4(4), 420–424.
Hassold TJ, Jacobs PA (1984) Trisomy in man. Annu Rev Genet. 18:69 97
Shaffer L et al. (1996). A clinical and molecular study of mosaicism for trisomy 17. Human Genetics, 97(1).
Cromossomo 18
O cromossomo 18 representa aproximadamente 2.5% do DNA total nas células. O cromossomo 18 provavelmente contém de 200 a 300 genes que fornecem instruções para a produção de proteínas que desempenham diferentes funções no corpo humano.
Monossomia (-18)
A monossomia do cromossomo 18 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+18)
A trissomia do cromossomo 18 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A maioria dos fetos portadores de trissomia do cromossomo 18, também conhecida como síndrome de Edwards, não chega a termo, ou seja, acaba indo a óbito durante a vida embrionária e fetal. Os bebês que nascem apresentam um prognóstico bastante reservado. De acordo com levantamento bibliográfico realizado por Rosa e colegas (Rosa et al., 2013), a mediana de sobrevida entre nascidos vivos relatada na literatura tem usualmente variado entre 2,5 e 14,5 dias.
De forma geral, dos recém-nascidos afetados, 55 a 65% vão a óbito na primeira semana de vida, 90% ao redor de seis meses e apenas 5 a 10% estarão vivos ao final do primeiro ano (Rosa et al., 2013). O padrão de síndrome reconhecível consiste em anomalias maiores e menores, deficiência de crescimento pré- e pós-natal, além de acentuada incapacidade psicomotora e cognitiva. Anomalias menores típicas incluem aspectos craniofaciais característicos, punho cerrado com dedos sobrepostos, unhas pequenas, polegares subdesenvolvidos e esterno curto. A presença de malformações graves é comum e as mais frequentes são anomalias cardíacas e renais. Os problemas de alimentação ocorrem de forma consistente e podem exigir nutrição enteral (Cereda & Carey, 2012).
Referências
Cereda A, Carey JC. (2012). The trisomy 18 syndrome. Orphanet J Rare Dis. Oct 23;7:81.
Rosa, R. F. M. et al. (2013). Trissomia 18: revisão dos aspectos clínicos, etiológicos, prognósticos e éticos. Revista Paulista de Pediatria, 31(1), 111–120.
Cromossomo 19
O cromossomo 19 representa mais de 2% do DNA total nas células. O cromossomo 19 provavelmente contém cerca de 1.500 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-19)
A monossomia do cromossomo 19 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+19)
A trissomia do cromossomo 19 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47 (três cópias ao invés de duas). Esta alteração não foi observada nos estudos de abortos no primeiro trimestre por ser muito rara (Warburton et al., 1991), mas a trissomia 19 em mosaico foi diagnosticada pelo menos duas vezes no pós-natal (Chen et al., 1981; Rethore et al., 1981). Nos dois casos, o dismorfismo facial foi o principal achado. No relato de Chen e colaboradores (Chen et al., 1981), a ultrassonografia pré-natal revelou polidrâmnio, edema na cabeça do feto e ascite abdominal. As características clínicas do probando incluíam hidropisia, prega epicântica, hipertelorismo, ponte nasal plana, nariz curto, boca pequena, orelhas de implantação baixas e malformadas, meato estreito, pescoço curto com excesso de pele, tórax curto, abdômen protuberante, encurtamento relativo moderado da porção proximal das extremidades, unhas em forma de colher, linhas simianas e pés em taco (Chen et al., 1981). A trissomia do cromossomo 19 é muito rara e pouco relatada em casos de aborto.
Referências
Chen H et al. (1981).Mosaic trisomy 19 syndrome. Ann Genet. 24(1):32-3.
Rethore M.O. et al. (1981). Sur un cas de trisomie 19 en mosaique, Ann. Genet., 24, 34–36.
Warburton D., Byrne, J., Canki, N. (Eds) (1991). Chromosome Anomalies and Prenatal Development: An Atlas. Oxford: Oxford University Press.
Cromossomo 20
O cromossomo 20 representa aproximadamente 2% do DNA total nas células. O cromossomo 20 provavelmente contém de 500 a 600 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-20)
A monossomia do cromossomo 20 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+20)
A trissomia do cromossomo 20 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 20 representa apenas cerca de 2% dos abortos trissômicos e quase nunca é diagnosticada em natimortos ou nascidos vivos (Hassold et al., 1996). Também não existem muitos casos de trissomia 20 em mosaico, mas certas características clínicas parecem ser recorrentes, incluindo alterações na pigmentação da pele, hipotonia e atraso no desenvolvimento psicomotor (Hsu et al., 1991; Bui et al., 1984; Willis et al., 2008).
Referências
Bui T-H et al. (1984). European collaborative study on prenatal diagnosis: Mosaicism, pseudomosaicism and single abnormal cells in amniotic fluid cell cultures. Prenat Diagn. 4:145-62.
Hassold T. et al. (1996). Human aneuploidy: incidence, origin and etiology. Environ Mol Mutagen 28: 167–175.
Hsu L et al. (1991). A revisit of trisomy 20 mosaicism in prenatal diagnosis – an overview of 103 cases. Prenat Diagn. 1:7-15.
Willis MJ et al. (2008). Expanding the Phenotype of Mosaic Trisomy 20. Am J Med Genet A. 146A:330-6.
Cromossomo 21
O cromossomo 21 representa aproximadamente 2% do DNA total nas células. O cromossomo 21 provavelmente contém de 200 a 300 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-21)
A monossomia do cromossomo 21 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e existem poucos relatos de nascidos vivos com esse tipo de aneuploidia. Mori e colegas (Mori et al., 2003) relataram um caso de um paciente com uma monossomia 21 diagnosticada no pré-natal, por meio do sangue do cordão umbilical e, subsequentemente, confirmada em outros tecidos. Translocações cromossômicas sutis do cromossomo 21 foram descartadas pela técnica de hibridação in situ (FISH) usando sondas painting e 21q teloméricas. O feto apresentou, às 32 semanas de gestação, um grave atraso de crescimento intrauterino e microcefalia. Ele nasceu com múltiplas malformações congênitas, hipotonia, microcefalia, microftalmia bilateral (mais grave à esquerda), dismorfismo facial, agenesia do conduto auditivo externo, pele redundante na nuca, peito estreito, escroto plano, criptorquidia, hipospádia, micropênis, camptodactilia, hipoplasia ungueal e alterações palmares e vincos plantares e morreu no primeiro dia de vida (Mori et al., 2003). Burgess e colaboradores (Burgess et al., 2014) publicaram um caso de um recém-nascido com monossomia 21 em mosaico com múltiplas alterações que morreu aos 4,5 meses.
Referências
Mori, MA et al. (2003). A prenatally diagnosed patient with full monosomy 21: Ultrasound, cytogenetic, clinical, molecular, and necropsy findings. American Journal of Medical Genetics Part A, 127A(1), 69–73.
Burgess, T et al (2014). Monosomy 21 seen in live born is unlikely to represent true monosomy 21: a case report and review of the literature. Case reports in genetics, 2014, 965401.
Trissomia (+21)
A trissomia do cromossomo 21 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. A trissomia 21 é conhecida como síndrome de Down (SD). A não disjunção é o tipo mais comum, respondendo por 95% dos casos. Cerca de 4% dos casos da trissomia do cromossomo 21 estão associados a uma herança genética familiar de Translocação Robertsoniana (Perkins, 2017). Esse tipo de translocação envolve sempre dois cromossomos, sendo que, quando o cromossomo 21 for um dos envolvidos, existe um risco superior de manifestação da síndrome. Estima-se que 30 a 40% das gestações diagnosticadas com trissomia 21 terminará em perda espontânea entre os primeiro trimestre e termo (Hook et al., 1995; Halliday et al., 1995. Em nascido, a SD é a causa genética mais comum de deficiências intelectuais em todo o mundo, apresentando vários problemas adicionais de saúde que incluem defeitos cardíacos, características dismórficas, distúrbios hematopoiéticos e doença de Alzheimer de início precoce, por volta dos 50 anos de idade (Jiang et al., 2013; Wiseman et al. 2015; Malt et al., 2013).
Referências
Jiang J et al. (2013). Translating dosage compensation to trisomy 21. Nature. 2013;500:296–300.
Malt EA et al. (2013). Health and disease in adults with Down syndrome. Tidsskr Nor Laegeforen.133:290–4.
Perkins A (2017). The lowdown on Down syndrome. Wolters Kluwer Health 15, 40e46.
Wiseman FK et al. (2015). A genetic cause of Alzheimer disease: mechanistic insights from Down syndrome. Nat Rev Neurosci.16:564–74.
Cromossomo 22
O cromossomo 22 representa de 1.5 a 2% do DNA total nas células. O cromossomo 22 provavelmente contém de 500 a 600 genes que fornecem instruções para fazer proteínas que possuem uma variedade de papéis diferentes no corpo humano.
Monossomia (-22)
A monossomia do cromossomo 22 indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45, e não existem relatos de nascidos vivos com esse tipo de aneuploidia. Nos abortamentos, as monossomias dos autossomos são observadas menos frequentemente do que as monossomias X, sendo responsáveis por perdas gestacionais muito precoces – abortos pré-clínicos (Goddijn & Leschot, 2000; Christiansen et al., 2005; Bottomley & Bourne, 2009).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Trissomia (+22)
A trissomia do cromossomo 22 indica que existe um cromossomo adicional, elevando o número total de cromossomos para 47. Essa alteração foi identificada como a terceira trissomia mais comum em abortos espontâneos, representando de 11 a 16% dos casos (Ford et al., 1996; Menasha et al., 2005). Devido a malformações severas de órgãos − microcefalia/anormalidades cranianas, cardiopatia congênita, malformações renais e atraso do crescimento intrauterino (RCIU) −, gravidez a termo ou a curto prazo e/ou sobrevida pós-natal são eventos muito raros. Entre 23 crianças nascidas com trissomia 22, Tinkle e colegas (Tinkle et al.,2003) encontraram uma sobrevida média de apenas 4 dias.
Referências
Ford JH et al. (1996). A 13-year cytogenetic study of spontaneous abortion: clinical applications of testing. Aust N Z J Obstet Gynaecol. 36:314–318.
Menasha J et al. (2005). Incidence and spectrum of chromosome abnormalities in spontaneous abortions: new insights from a 12-year study. Genet Med. 7:251–263.
Tinkle BT et al. (2003). Unexpected survival in a case of prenatally diagnosed non-mosaic trisomy 22: clinical report and review of the natural history. Am J Med Genet A. 118A:90–95.
Cromossomo X
O cromossomo X é um dos dois cromossomos sexuais em humanos (o outro é o cromossomo Y). Os cromossomos sexuais formam um dos 23 pares de cromossomos humanos em cada célula. O cromossomo X abrange cerca de 155 milhões de blocos de construção de DNA (pares de bases) e representa aproximadamente 5% do DNA total nas células. Como os pesquisadores usam abordagens diferentes para prever o número de genes em cada cromossomo, o número estimado de genes varia. O cromossomo X provavelmente contém de 800 a 900 genes que fornecem instruções para a produção de proteínas.
Monossomia do X (X0)
A monossomia do cromossomo X indica que um dos pares desse cromossomo está ausente nas células, reduzindo seu número total de cromossomos para 45. As mulheres com uma única cópia do cromossomo X têm a condição conhecida como síndrome de Turner (O’Connor, 2008). A síndrome de Turner apresenta uma incidência de apenas 1 em 2.500 a 3.000 meninas nascidas vivas por causa da elevada frequência de aborto espontâneo (Sybert & McCauley, 2004; Mashour et al., 2005). A síndrome de Turner está associada a baixa estatura, puberdade tardia, disgenesia ovariana, hipogonadismo hipergonadotrópico, infertilidade, malformações congênitas do coração, distúrbios endócrinos como diabetes mellitus tipos 1 e 2, osteoporose e distúrbios autoimunes. A morbimortalidade aumenta em mulheres com síndrome de Turner, em comparação com a população em geral, e o envolvimento de múltiplos órgãos em todas as fases da vida exige uma abordagem multidisciplinar de cuidados (Gravholt et al., 2019).
Referências
Gravholt CH et al. (2019). Turner syndrome: mechanisms and management. Nature Reviews Endocrinology.
Mashour GA et al. (2005). Anesthetic management of Turner syndrome: a systematic approach. J Clin Anesth. 17:128-130.
O’Connor C. (2008) Chromosomal abnormalities: Aneuploidies. Nature Education 1(1):172
Sybert VP, McCauley E. (2004). Medical progress: Turner’s syndrome. N Engl J Med, 2004;351;1227-1233.
Trissomia do X (XXX)
Originalmente descrita como a “superfêmea” em 1959, a trissomia X ocorre em aproximadamente 1 em 1.000 nascimentos femininos, no entanto, estima-se que apenas aproximadamente 10% dos casos sejam diagnosticados (Nielsen, 1990). De acordo com Tartaglia e colegas (Tartaglia et al., 2010), as características físicas mais comuns incluem estatura alta, pregas epicânticas, hipotonia e clinodactilia. Convulsões, anormalidades renais e geniturinárias e insuficiência ovariana prematura (FOP) também podem ser achados associados. Crianças com trissomia X apresentam maiores taxas de atraso motor e de fala, com risco aumentado de déficits cognitivos e dificuldades de aprendizagem nos anos escolares. Características psicológicas, incluindo déficits de atenção, transtornos do humor (ansiedade e depressão) e outros distúrbios psicológicos também são mais comuns do que na população em geral (Tartaglia et al., 2010).
Referências
Nielsen J. (1990). Sex Chromosome Abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark. Birth Defects Orig Artic Ser. 26 (4): 209-23.
Tartaglia N et al. (2010). A review of trisomy X (47,XXX). Orphanet journal of rare diseases.
Cromossomo Y
O cromossomo Y é um dos dois cromossomos sexuais em humanos (o outro é o cromossomo X). O cromossomo Y abrange mais de 59 milhões de blocos de DNA (pares de bases) e representa quase 2% do DNA total nas células. Cada pessoa normalmente tem um par de cromossomos sexuais em cada célula. O cromossomo Y está presente nos homens, que têm um cromossomo X e um Y, enquanto as mulheres têm dois cromossomos X. Como os pesquisadores usam abordagens diferentes para prever o número de genes em cada cromossomo, o número estimado de genes varia. O cromossomo Y provavelmente contém de 50 a 60 genes que fornecem instruções para a produção de proteínas. Como apenas os homens têm o cromossomo Y, os genes desse cromossomo tendem a estar envolvidos na determinação e desenvolvimento do sexo masculino. O sexo é determinado pelo gene SRY, responsável pelo desenvolvimento de um feto menino.
XXY − Klinefelter
A síndrome de Klinefelter (SK) é o resultado de 2 ou mais cromossomos X em um paciente do sexo masculino. A incidência é de 1 a cada 600 meninos nascidos vivos. O fenótipo clínico da SK foi descrito pela primeira vez em homens com estatura alta, testículos pequenos, ginecomastia e azoospermia com a etiologia genética de cromossomos X supranumerários identificados em 1959 (Jacobs & Strong, 1959). Os cromossomos X extras levam à hialinização testicular, fibrose e hipofunção testicular, o que pode resultar em alterações genitais e, geralmente, hipogonadismo e infertilidade. As diferenças neurocognitivas associadas à SK começaram a ser reconhecidas na metade e no final do século XX (Daly, 1969). Frequentemente, a reposição de andrógenos e terapias neuropsicológicas e adaptativas são benéficas no tratamento médico da SK (Davis et al., 2016; Ross et al., 2017).
Referências
Daly RF (1969). Mental illness and patterns of behavior in 10 XXY males. J. Nerv. Ment. Dis. Oct;149(4):318-27.
Davis S et al. (2016). Advances in the Interdisciplinary Care of Children with Klinefelter Syndrome. Adv Pediatr. Aug;63(1):15-46.
JACOBS PA, STRONG JA. (1959). A case of human intersexuality having a possible XXY sex-determining mechanism. Nature. Jan 31;183(4657):302-3.
Ross JL et al. (2017). Treatment Effects on Motor Function, Cognition, and Behavior in Boys with Klinefelter Syndrome. J. Pediatr.Jun;185:193-199.e4
XYY – Síndrome Jacobs
A síndrome de Jacobs (47, XYY) é a alteração dos cromossomos sexuais mais comum após a síndrome de Klinefelter (47, XXY) (Gekas et al., 2001; Hook & Hameron, 1977; Rives et al., 2005), ocorrendo em aproximadamente 1 em cada 1000 nascidos masculinos vivos (Jacobs et al., 1974; Morel et al., 1999). O diagnóstico da síndrome de 47, XYY é frequentemente mais tardio devido à falta de características fenotípicas distintivas em comparação com homens com 46, XY. As manifestações clínicas que podem levar ao teste e diagnóstico da análise cromossômica podem incluir problemas de comportamento, aumento do crescimento durante a adolescência, leve dificuldade de aprendizado e atraso nas habilidades de fala e linguagem (El-Dahtory F, Elsheikha HM, 2009).
Referências
El-Dahtory F, Elsheikha HM.(2009). Male infertility related to an aberrant karyotype, 47,XYY: four case reports. Cases J.2:28
Gekas J et al. (2001). Chromosomal factors of infertility in candidate couples for ICSI: an equal risk of constitutional aberrations in women and men. Hum Reprod. 2001;16:82–90.
Hook EB, Hamerton JL. (1977). The frequency of chromosome abnormalities detected in consecutive newborn studies-differences between studies-results by sex and by severity of phenotypic involvement. In: Hook EB, Porter IH, editors. Population Cytogenetics. New York: Academic Press; 1977. pp. 63–79.
Jacobs PA et al. (1974). A cytogenetic survey of 11,680 newborn infants. Ann Hum Genet. 1974;37:359–376.
Morel F et al. (1999). Sex chromosome aneuploidies in sperm of 47,XYY men. Arch Androl. 1999;43:27–36.
Rives N et al. (2005) From spermatocytes to spermatozoa in an infertile XYY male. Int J Androl. 28:304–310.
O cromossomo 1 é classificado como metacêntrico e corresponde ao maior dos 23 pares que compõem o genoma humano. Ele possui mais de 3.400 genes e muitas centenas deles estão relacionados ao desenvolvimento e formação de órgãos do corpo.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Banzai et al. (2004). Trisomy 1 in a case of a missed abortion. Journal of human genetics. 49. 396-7. 10.1007/s10038-004-0164-1.
Dunn TM, Grunfeld L, Kardon NB. (2001). Trisomy 1 in a clinically recognized IVF pregnancy. Am J Med Genet 2001;99:152-3.
Vičić A. et al. (2008). Trisomy 1 in an early pregnancy failure. American Journal of Medical Genetics Part A, 146A(18), 2439–2441.
O cromossomo 2 é classificado como metacêntrico e corresponde ao segundo maior dos 23 pares que compõem o genoma humano. Ele contém aproximadamente 1.500 genes, dos quais 200 estão relacionados a diferentes tipos de patologias genéticas.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB, et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Cramer A et al. (1993). Tissue-specific trisomy 2 mosaicism in an infant with Pfeiffer syndrome-like features. Am J Hum Genet 53:538.
Gupta S et al. (2007). Trisomy 2 mosaicism in hypomelanosis of Ito. Am J Med Genet 143A:2466–2468.
Pappas J et al. (1995). Trisomy 2 mosaicism. Am J Hum Genet 57:A286.
Hassold T., Jacobs P. (1984). Trisomy in Man. Ann Rev Genet 18:392–395.
Sago H et al. (1997). True trisomy 2 mosaicism in amniocytes and newborn liver associated with multiple system abnormalities. Am J Med Genet 72:343–346.
O cromossomo 3 representa mais de 6,5% do DNA total nas células. A identificação de genes em cada cromossomo é uma área ativa de pesquisa genética. O cromossomo 3 provavelmente contém 1.500 genes que fornecem instruções para produzir proteínas que possuem diferentes funções no corpo humano.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
De Keyser F et al. (1988). Trisomy 3 mosaicism in a patient with Bartter syndrome. J Med Genet 25:358.
Jackson-Cook C. (2011). Constitutional and acquired autosomal aneuploidy. Clin Lab Med 31:481–511.
Kuhn EM, Sarto GE, Bates BJ, Therman E. (1987). Gene-rich chromosome regions and autosomal trisomy. A case of chromosome 3 trisomy mosaicism. Hum Genet 77:214–220.
Metaxotou C et al. (1981). Trisomy 3 mosaicism in a live-born infant. Clin Genet 19:37–40.
Yang Y. et al (2016). Trisomy 3 mosaicism in a 5-year-old boy with multiple anomalies: A very rare case. American Journal of Medical Genetics Part A, 170(6), 1590–1594.
O cromossomo 4 representa mais de 6% do DNA total das células. O cromossomo 4 provavelmente contém de 1.000 a 1.100 genes que fornecem instruções para produção de proteínas que desempenham diferentes funções no corpo humano.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
A trissomia 4 em mosaico é rara em nascidos vivos, pois aproximadamente quatro casos foram confirmados (Marion et al., 1990; Wieczorek et al., 2003; Brady et al., 2005; Lal & Di, 2015). Com base nesses quatro pacientes, o fenótipo comum da trissomia 4 em mosaico parece incluir: restrição de crescimento intrauterino (RCIU) (3/3), baixo peso ao nascer/tamanho/diâmetro occipital-frontal (3/3), defeitos cardíacos congênitos (3/3), anomalias características do polegar (3/3), anormalidades da pele (3/4) e vários dismorfismos faciais (assimetria da face, alterações da sobrancelha, baixa implantação de orelhas, orelhas rotadas posteriormente e micro/retrognatia).
Referências
Brady AN, May KM, Fernhoff PM. (2005). Mosaic trisomy 4: Long-term outcome on the first reported liveborn. Am J Med Genet Part A 132A:411–413.
Lal K, Di Lernia V. (2015). Linear and whorled naevoid hypermelanosis in a patient with trisomy 4 mosaicism. Clin Exp Dermatol 40:45–47.
Marion JP et al. (1990). Pre- and post-natal diagnosis of trisomy 4 mosaicism. Am J Med Genet 37:362–365.
Van Allen, M. I. et al.(1993). Trisomy 4 in a fetus with cyclopia and other anomalies. American Journal of Medical Genetics, 46(2), 193–197.
Wieczorek D et al. (2003). Prenatally detected trisomy 4 and 6 mosaicism-cytogenetic results and clinical phenotype. Prenat Diagn 23:128–133.
O cromossomo 5 representa cerca de 6% do DNA total nas células. O cromossomo 5 tem uma baixa densidade de genes, pois a maioria de suas partes possui regiões gênicas não codificantes.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Brown, S. (2008). Miscarriage and its associations. Seminars in Reproductive Medicine, 26, 391–400.
Ikeuchi T, Sasaki M. (1974). A spontaneous abortus with trisomy 5 identified by fluorescent techniques. Proc Japan Acad, 1974; 50: 503–6.
Ohama K, Kusumi I. (1976). Trisomy 5 in two abortuses. Jap J Human Genet, 1976; 21: 1–4.
Sciorra, L. J et al. (1992). Trisomy 5 mosaicism detected prenatally with an affected liveborn. Prenatal Diagnosis, 12, 477–482.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Hassold T et al. (1980). Cytogenetic study of 1,000 spontaneous abortions. Ann Hum Genet 44:151–178.
Wegner et al. (2004). Prenatal Diagnosis of Fetal Trisomy 6 Mosaicism and Phenotype of the Affected Newborn. American journal of medical genetics. Part A. 124A. 85-8. 10.1002/ajmg.a.20407.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Warburton D, Byrne J, Canki N (1991). Chromosomal Anomalies and Prenatal Development: An Atlas. New York. Oxford University Press.
Warburton D, Stein Z, Klijne J, Susser M. (1980). Chromosome abnormalities in spontaneous abortion. In: Potte IH, Hook EB eds. Human Embryonic and Fetal Death. New York: Academic Press, 1980: 261–88
Furau, Cristian. (2016). Mosaic trisomy 7. Archives of the Balkan Medical Union. 51. 261-266.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Campbell S et al. (2001). Prenatal diagnosis of mosaic trisomy 8 in a fetus with normal nuchal translucency thickness and reversed end-diastolic ductus venosus flow. Ultrasound Obstet Gynecol. 17(4): 341-3.
Jordan MA et al. (1998). Trisomy 8 mosaicism: a further five cases illustrating marked clinical and cytogenetic variability. Genet Couns. 9:139e46.
Wisniewska M, Mazurek M (2002). Trisomy 8 mosaicism syndrome. J Appl Genet. 43:115e8.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Arnold G.L. et al. (1995). Trisomy 9: review and report of two new cases. Am J Med Genet. 56:252–7.
Okumura A. et al. (2000). Two patients with trisomy 9 mosaicism. Pediatr Int. 42:89–91.
Stoll C. et al. (1993). Trisomy 9 mosaicism in two girls with multiple congenital malformations and mental retardation. J Med Genet. 30:433–5. doi: 10.1136/jmg.30.5.433.
Wooldridge J, Zunich J. (1995). Trisomy 9 syndrome: report of a case with Crohn disease and review of the literature. Am J Med Genet. 56:258–64.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Boon C. et al. (1996). Partial trisomy 10 mosaicism with cutaneous manifestations: report of a case and review of the literature. Clin Genet. 50: 417–21.
Boue J. et al. (1975). Identification of C trisomies in human abortuses. J Med Genet.12:265–8.
Brizot M.L. et al. (2001). Trisomy 10: ultrasound features and natural history after first trimester diagnosis. Prenat Diagn. Aug;21(8):672–5.
Byrne J. et al. (1985). Morphology of early fetal deaths and their chromosomal characteristics. Teratology.32:297–315.
De France H.F. et al. (1985). Trisomy 10 mosaicism in a newborn boy; delineation of the syndrome. Clin Genet. 27:92–6.
Hahnemann J.M. et al. (2005). Trisomy 10 mosaicism and maternal uniparental disomy 10 in a liveborn infant with severe congenital malformations. Am J Med Genet A. 138A(2):150–4.
Hassold T. et al. (1984). The relationship of maternal age and trisomy among trisomic spontaneous abortions. Am J Hum Genet. 36:1349–56.
Mielke G. et al. (1997). Prenatal detection of double aneuploidy trisomy 10/monosomy X in a liveborn twin with exclusively monosomy X in blood. Clin Genet. 51:275–7.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Balasubramanian, M. (2011). Mosaic trisomy 11 in a fetus with bilateral renal agenesis. Clinical Dysmorphology, 20(1), 47–49.
Wilmot PL et al. (1983). Trisomy 11: a severely disruptive influence. Am J Hum Genet 35:162ª.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Al-Hertani W et al. (2012). Novel clinical findings in a case of postnatally diagnosed trisomy 12 mosaicism. Am J Med Genet 158A:1452–1454.
Bischoff FZ et al. (1995). Mosaicism for trisomy 12: four cases with varying outcomes. Prenat Diagn 15:1017–1026 (1995).
Chen CP et al. (2013). Mosaic trisomy 12 at amniocentesis: prenatal diagnosis and molecular genetic analysis. Taiwan J Obstet Gynecol 52: 97–105.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Patau K et al (1960). Multiple congenital anomaly caused by an extra autosome. Lancet. Apr 09;1(7128):790-3.
Peroos S et al. (2012). Longevity and Patau syndrome: what determines survival? BMJ Case Rep. 2012 Dec 06.
Petry P et al. (2013). Clinical features and prognosis of a sample of patients with trisomy 13 (Patau syndrome) from Brazil. Am. J. Med. Genet. A. Jun;161A(6):1278-83.
Wyllie JP et al. (1994). Natural history of trisomy 13. Arch. Dis. Child. 1994 Oct;71(4):343-5.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Fagerberg CR et al. (2012). Trisomy 14 mosaicism: clinical and cytogenetic findings in an adult. Clin Dysmorphol. 21:45–47.
Lynch MF et al. (2004). Trisomy 14 mosaicism: a case report and review of the literature. J Perinatol 2004, 24:121–123.
Shinawi M et al. (2008).Low-level mosaicism of trisomy 14: phenotypic and molecular characterization. Am J Med Genet A 2008, 146A: 1395–1405. 10.1002/ajmg.a.32287
Von Sneidern E, Lacassie Y. (2008). Is trisomy 14 mosaic a clinically recognizable syndrome?–case report and review. Am J Med Genet A. 146A:1609–1613.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Bennett CP, Davis T, Seller MJ (1992). Trisomy 15 mosaicism in an IVF fetus. J Med Genet 29:745–746.
Knauer-Fischer SA et al. (2004). Mosaic trisomy 15 in a short girl with hemihypotrophy and mental retardation. Clinical Dysmorphology, 13(3), 183–186.
Markovic VD et al. (1996). Trisomy 15 mosaic derived from trisomic conceptus: report of a case and a review. Am J Med Genet 61:363–370.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen O B et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot N J. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Chareonsirisuthigul T et al. (2014). Intrauterine growth retardation fetus with trisomy 16 mosaicis. Case Rep Genet. 2014:739513.
Neiswanger K et al. (2006). Variable outcomes in mosaic trisomy 16: five case reports and literature analysis. Prenatal Diagnosis, 26(5), 454–461.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Baltensperger, A., Haischer, G., & Rohena, L. (2016). Rare case of live born with confirmed mosaic trisomy 17 and review of the literature. Clinical Case Reports, 4(4), 420–424.
Hassold TJ, Jacobs PA (1984) Trisomy in man. Annu Rev Genet. 18:69 97
Shaffer L et al. (1996). A clinical and molecular study of mosaicism for trisomy 17. Human Genetics, 97(1).
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
De forma geral, dos recém-nascidos afetados, 55 a 65% vão a óbito na primeira semana de vida, 90% ao redor de seis meses e apenas 5 a 10% estarão vivos ao final do primeiro ano (Rosa et al., 2013). O padrão de síndrome reconhecível consiste em anomalias maiores e menores, deficiência de crescimento pré- e pós-natal, além de acentuada incapacidade psicomotora e cognitiva. Anomalias menores típicas incluem aspectos craniofaciais característicos, punho cerrado com dedos sobrepostos, unhas pequenas, polegares subdesenvolvidos e esterno curto. A presença de malformações graves é comum e as mais frequentes são anomalias cardíacas e renais. Os problemas de alimentação ocorrem de forma consistente e podem exigir nutrição enteral (Cereda & Carey, 2012).
Referências
Cereda A, Carey JC. (2012). The trisomy 18 syndrome. Orphanet J Rare Dis. Oct 23;7:81.
Rosa, R. F. M. et al. (2013). Trissomia 18: revisão dos aspectos clínicos, etiológicos, prognósticos e éticos. Revista Paulista de Pediatria, 31(1), 111–120.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Chen H et al. (1981).Mosaic trisomy 19 syndrome. Ann Genet. 24(1):32-3.
Rethore M.O. et al. (1981). Sur un cas de trisomie 19 en mosaique, Ann. Genet., 24, 34–36.
Warburton D., Byrne, J., Canki, N. (Eds) (1991). Chromosome Anomalies and Prenatal Development: An Atlas. Oxford: Oxford University Press.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Bui T-H et al. (1984). European collaborative study on prenatal diagnosis: Mosaicism, pseudomosaicism and single abnormal cells in amniotic fluid cell cultures. Prenat Diagn. 4:145-62.
Hassold T. et al. (1996). Human aneuploidy: incidence, origin and etiology. Environ Mol Mutagen 28: 167–175.
Hsu L et al. (1991). A revisit of trisomy 20 mosaicism in prenatal diagnosis – an overview of 103 cases. Prenat Diagn. 1:7-15.
Willis MJ et al. (2008). Expanding the Phenotype of Mosaic Trisomy 20. Am J Med Genet A. 146A:330-6.
Referências
Mori, MA et al. (2003). A prenatally diagnosed patient with full monosomy 21: Ultrasound, cytogenetic, clinical, molecular, and necropsy findings. American Journal of Medical Genetics Part A, 127A(1), 69–73.
Burgess, T et al (2014). Monosomy 21 seen in live born is unlikely to represent true monosomy 21: a case report and review of the literature. Case reports in genetics, 2014, 965401.
Referências
Jiang J et al. (2013). Translating dosage compensation to trisomy 21. Nature. 2013;500:296–300.
Malt EA et al. (2013). Health and disease in adults with Down syndrome. Tidsskr Nor Laegeforen.133:290–4.
Perkins A (2017). The lowdown on Down syndrome. Wolters Kluwer Health 15, 40e46.
Wiseman FK et al. (2015). A genetic cause of Alzheimer disease: mechanistic insights from Down syndrome. Nat Rev Neurosci.16:564–74.
Referências
Bottomley C, Bourne T. (2009). Diagnosing miscarriage. Best practice & research Clinical obstetrics & gynaecology.23(4):463-477.
Christiansen OB et al. (2005). Evidence-based investigations and treatments of recurrent pregnancy loss. Fertility and sterility.83(4):821-39.
Goddijn M, Leschot NJ. (2000). Genetic aspects of miscarriage. Bailliere’s best practice & research Clinical obstetrics & gynaecology.14(5):855-865.
Referências
Ford JH et al. (1996). A 13-year cytogenetic study of spontaneous abortion: clinical applications of testing. Aust N Z J Obstet Gynaecol. 36:314–318.
Menasha J et al. (2005). Incidence and spectrum of chromosome abnormalities in spontaneous abortions: new insights from a 12-year study. Genet Med. 7:251–263.
Tinkle BT et al. (2003). Unexpected survival in a case of prenatally diagnosed non-mosaic trisomy 22: clinical report and review of the natural history. Am J Med Genet A. 118A:90–95.
Referências
Gravholt CH et al. (2019). Turner syndrome: mechanisms and management. Nature Reviews Endocrinology.
Mashour GA et al. (2005). Anesthetic management of Turner syndrome: a systematic approach. J Clin Anesth. 17:128-130.
O’Connor C. (2008) Chromosomal abnormalities: Aneuploidies. Nature Education 1(1):172
Sybert VP, McCauley E. (2004). Medical progress: Turner’s syndrome. N Engl J Med, 2004;351;1227-1233.
Referências
Nielsen J. (1990). Sex Chromosome Abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark. Birth Defects Orig Artic Ser. 26 (4): 209-23.
Tartaglia N et al. (2010). A review of trisomy X (47,XXX). Orphanet journal of rare diseases.
Referências
Daly RF (1969). Mental illness and patterns of behavior in 10 XXY males. J. Nerv. Ment. Dis. Oct;149(4):318-27.
Davis S et al. (2016). Advances in the Interdisciplinary Care of Children with Klinefelter Syndrome. Adv Pediatr. Aug;63(1):15-46.
JACOBS PA, STRONG JA. (1959). A case of human intersexuality having a possible XXY sex-determining mechanism. Nature. Jan 31;183(4657):302-3.
Ross JL et al. (2017). Treatment Effects on Motor Function, Cognition, and Behavior in Boys with Klinefelter Syndrome. J. Pediatr.Jun;185:193-199.e4
Referências
El-Dahtory F, Elsheikha HM.(2009). Male infertility related to an aberrant karyotype, 47,XYY: four case reports. Cases J.2:28
Gekas J et al. (2001). Chromosomal factors of infertility in candidate couples for ICSI: an equal risk of constitutional aberrations in women and men. Hum Reprod. 2001;16:82–90.
Hook EB, Hamerton JL. (1977). The frequency of chromosome abnormalities detected in consecutive newborn studies-differences between studies-results by sex and by severity of phenotypic involvement. In: Hook EB, Porter IH, editors. Population Cytogenetics. New York: Academic Press; 1977. pp. 63–79.
Jacobs PA et al. (1974). A cytogenetic survey of 11,680 newborn infants. Ann Hum Genet. 1974;37:359–376.
Morel F et al. (1999). Sex chromosome aneuploidies in sperm of 47,XYY men. Arch Androl. 1999;43:27–36.
Rives N et al. (2005) From spermatocytes to spermatozoa in an infertile XYY male. Int J Androl. 28:304–310.