O mosaicismo cromossômico é um fenômeno secundário ao PGT e, portanto, sempre ligado a testes genéticos. A discussão da aplicação, benefício clínico e utilidade do PGT, e especificamente do PGT-A, não é o objetivo da pesquisa realizada pela ESHRE. O artigo apresentado na edição em Milão de 2022 se restringe a fornecer orientação sobre o manejo de embriões com um resultado de mosaicismo após biópsia te e PGT, sem fazer qualquer referência ao motivo ou indicações para o teste genético.
No que diz respeito à validade clínica, deve-se considerar até que ponto a biópsia de TE reflete com precisão o estado genético do restante do embrião, especialmente o ICM, mas também fatores e limitações técnicas que podem impactar a análise (artefatos técnicos, a técnica de biópsia, qualidade ou contaminação da amostra), e a validade da designação do mosaico e seu grau (Gleicher, et al., 2017). É evidente que mais estudos são necessários para determinar as taxas de concordância entre TE com um resultado de mosaico e ICM para confirmar qualquer validade clínica do mosaico.
A utilidade clínica pode ser definida como a probabilidade de uma melhor tomada de decisão e melhores resultados clínicos de considerar o mosaico como critério diagnóstico em comparação ou combinado com critérios anteriores de seleção de embriões. No que diz respeito ao impacto da transferência de embriões de mosaico nos desfechos da gravidez (taxa de nascidos vivos, taxa de aborto), as conclusões são difíceis de desenhar, pois estudos têm utilizado critérios diferentes de inclusão para os pacientes e diferentes limiares para designação de mosaico. Ao considerar a utilidade clínica e o impacto, deve-se considerar também que medidas rigorosas para determinar o mosaico e o manuseio de embriões de mosaico podem resultar em um potencial desperdício de embriões viáveis e saudáveis.
Além do mosaico de baixo versus alto grau, outros fatores também poderiam ser considerados na priorização de embriões. Alguns pesquisadores têm tentado criar estratégias de priorização de embriões com base em dados publicados sobre o resultado das transferências de embriões mosaico (taxa de nascido vivo, taxa de gravidez em curso, taxa de aborto), por exemplo, priorizando embriões de mosaico de baixo grau em vez de mosaicos complexos (com um corte de 50%), priorizando mosaicos segmentais sobre mosaicos inteiros e mosaicos únicos e duplos sobre mosaicos complexos (Mourad, et al., 2021). No entanto, dada a escassez de estudos prospectivos bem desenhados que avaliam o potencial dos embriões de mosaico, não está claro se tais estratégias têm alguma validade.
Qual é a relevância do mosaico no que diz respeito ao ranking de embriões e à transferência de embriões nos ciclos de PGT-A?
Há evidências de que o mosaico de grau baixo a moderado pode não afetar negativamente as taxas de nascidos vivos. No entanto, as consequências do mosaico de alto grau (>50%) permanecem menos bem estudadas, mas pode-se supor que a maioria dos embriões de mosaico de alto grau seria aneuploide e resultaria em falha de implantação ou aborto. Ainda assim, embriões de mosaico de alto grau podem resultar em gravidez e bebê saudável, e, portanto, poderiam fornecer chances de uma gravidez em casais sem outras opções de embrião saudável. Com o modesto PPV do mosaico de baixo grau, recomenda-se atualmente co-avaliar o mosaico com morfologia. As células aneuploides tendem a crescer mais lentamente e, como consequência da constituição genética diferente, podem ter diferentes formas celulares (Martín, et al., 2021, Zhang, et al., 2021). No entanto, muito ainda é desconhecido sobre a ligação entre morfologia e constituição genética, bem como sobre as características morfocinéticas. Outros estudos explorando a morfologia de mosaicos e embriões não-mosaicos em diferentes estágios de desenvolvimento poderiam fornecer maior clareza sobre a ligação entre eles, a relevância do mosaico e da morfologia e sua interdependência.
Qual é o resultado em relação à gravidez e à transferência de embriões com aneuploides de mosaico detectados durante o PGT?
O nível de mosaico na biópsia de TE já esteve relacionado à chance de nascido vivo após a transferência de embriões, mas ainda mais estudos seriam importantes para confirmar que as conclusões podem ser generalizadas para outras configurações (Spinella, et al., 2018). Preferencialmente, o tema deve ser investigado por meio de futuros ensaios cegos não seletivos que incluem embriões aneuploides de mosaico de baixo grau e/ou de alto grau. A maioria dos estudos disponíveis atualmente tem focado na implantação e gravidez, mas não no nascido vivo e na saúde do recém-nascido. Outro aspecto a ser incluído na pesquisa é a análise genética do produto de aborto após a perda da gravidez. Os dados do mundo real poderiam fornecer mais informações sobre os resultados pré e pós-natal da transferência de embriões de mosaico. O acompanhamento pré-natal é amplamente implementado na prática clínica, mas esses dados não são sistematicamente registrados ou compartilhados com a comunidade científica. Somente através do registro sistemático em larga escala do grau e tipo de mosaico no embrião transferido, dados de acompanhamento pré-natal e desfechos de nascimento, serão reveladas as consequências clínicas completas da transferência de embriões de mosaico. Nesse registro sistemático em larga escala, embriões diagnosticados com desequilíbrios segmentais (mosaico) também devem ser incluídos para esclarecer o destino desses embriões e poderiam orientar futuras tomadas de decisão em relação à sua transferência.
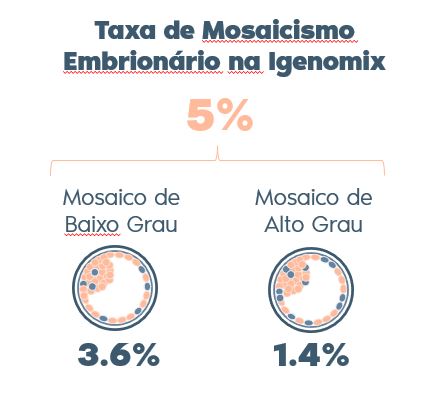
Como acompanhar as taxas de mosaicismo embrionário de sua clínica?
Clínicas parceiras da Igenomix contam com a ferramenta de Dashboard para acompanhar suas taxas de mosaicismo e compará-la com os resultados nacionais e globais de nossos laboratórios de genética.

Referências
Bolton H, Graham SJL, Van der Aa N, Kumar P, Theunis K, Fernandez Gallardo E, Voet T, Zernicka-Goetz Capalbo A, Poli M, Rienzi L, Girardi L, Patassini C, Fabiani M, Cimadomo D, Benini F, Farcomeni A, Cuzzi J et al. Embriões de pré-implantação humana de mosaico e seu potencial de desenvolvimento em um teste clínico prospectivo e não-selecionado. Sou J Hum Genet. 2021.
Chuang TH, Hsieh JY, Lee MJ, Lai HH, Hsieh CL, Wang HL, Chang YJ, Chen SU. Concordância entre diferentes locais de biópsia de trophectoderm e a massa celular interna da composição cromossômica medida com uma plataforma de sequenciamento de próxima geração. Mol Hum Reprod. 2018; 24: 593-601.
O COGEN. Declaração de Posição COGEN sobre mosaicismo cromossômico detectado em Biópsias blastocistos pré-implantação. https://ivf-worldwidecom/cogen/oep/publications/cogen-position-statement-on-chromosomal-mosaicism-detected-in-preimplantation-blastocyst-biopsieshtml.
Coonen E, van Montfoort A, Carvalho F, Kokkali G, Moutou C, Rubio C, De Rycke M, Goossens V. ESHRE PGT Consortium coleta XVI–XVIII: ciclos de 2013 a 2015†. Reprodução Humana Aberta. 2020; 2020.
Cram DS, Leigh D, Handyside A, Rechitsky L, Xu K, Harton G, Grifo J, Rubio C, Fragouli E, Kahraman S et al. Declaração de Posição pgdis sobre a transferência de embriões mosaicos 2019. Reprod Biomed Online. 2019; 39 Suppl 1: e1-e4.
ESHRE PGT-M Grupo de Trabalho, Carvalho F, Moutou C, Dimitriadou E, Dreesen J, Giménez C, Goossens V, Kakourou G, Vermeulen N, Zuccarello D et al. Recomendação de boas práticas do Consórcio ESHRE PGT para a detecção de distúrbios monogênicos. Reprodução Humana Aberta. 2020; 2020.
ESHRE PGT-SR/PGT-A Grupo de Trabalho, Coonen E, Rubio C, Christopikou D, Dimitriadou E, Gontar J, Goossens V, Maurer M, Spinella F, Vermeulen N et al. Recomendação de boas práticas do Consórcio ESHRE PGT para a detecção de aberrações cromossômicas estruturais e numéricas. Reprodução Humana Aberta. 2020; 2020: hoaa017.
ESHRE PGT Consórcio e SIG-Embryology Biopsia Grupo de Trabalho, Kokkali G, Coticchio G, Bronet F, Celebi C, Cimadomo D, Goossens V, Liss J, Nunes S, Sfontouris I et al. Recomendação de boas práticas do Consórcio ESHRE PGT e da SIG Embryology para biópsia de corpo polar e embrião para PGT. Reprodução Humana Aberta. 2020; 2020.
Comitê Gestor do Consórcio ESHRE PGT, Carvalho F, Coonen E, Goossens V, Kokkali G, Rubio C, Meijer-Hoogeveen M, Moutou C, Vermeulen N, De Rycke M. ESHRE PGT Consórcio recomendações de boas práticas para a organização da PGT. Reprodução Humana Aberta. 2020; 2020.
Fragouli E, Munne S, Wells D. A constituição citogenética dos blastocistos humanos: insights de estratégias abrangentes de triagem de cromossomos. Atualização Hum Reprod. 2019; 25: 15-33.
Friedenthal J, Maxwell SM, Tiegs AW, Besser AG, McCaffrey C, Munné S, Noyes N, Grifo JA. Taxas de erro clínico de sequenciamento de próxima geração e hibridização genômica comparativa de array com transferência de embrião euploide degelo único. Eur J Med Genet. 2020; 103852.
Gleicher N, Albertini DF, Barad DH, Homer H, Modi D, Murtinger M, Patrizio P, Orvieto R, Takahashi S, Weghofer A et al. A declaração de posição pgdis 2019 sobre a transferência de embriões de mosaico dentro de um contexto de novas informações sobre PGT-A. Reprod Biol Endocrinol. 2020; 18: 57.
Gleicher N, Metzger J, Croft G, Kushnir VA, Albertini DF, Barad DH. Uma única biópsia de trophectoderm no estágio blastocisto é matematicamente incapaz de determinar ploidy embrião com precisão suficiente para uso clínico. Reprod Biol Endocrinol. 2017; 15: 33.
Greco E, Minasi MG, Fiorentino F. Bebês Saudáveis após Transferência Intrauterina de Blastocistos Aneuploides do Mosaico. N Engl J Med. 2015; 373: 2089-2090.
Handyside AH, Harton GL, Mariani B, Thornhill AR, Affara N, Shaw MA, Griffin DK. Karyomapping: um método universal para análise ampla do genoma da doença genética baseada no mapeamento de crossovers entre haplotipos parentais. Med Genet. 2010; 47: 651-658.
Handyside AH, McCollin A, Summers MC, Ottolini CS. Copie a análise numéptica de aneuploidies mitotísticos meioticos e pós-zigoóticos em células de trophectoderm biópsias no estágio blastocisto e embriões presos. Diagn pré-dia. 2021; 41: 525-535.
Kahraman S, Cetinkaya M, Yuksel B, Yesil M, Pirkevi Cetinkaya C. O nascimento de um bebê com mosaico resultante de uma transferência conhecida de embriões de mosaico: um relatório de caso. Hum Reprod. 2020; 35: 727-733.
Leigh D, Cram DS, Rechitsky S, Handyside A, Wells D, Munne S, Kahraman S, Grifo J, Katz-Jaffe M, Rubio C et al. Declaração de posição do PGDIS sobre a transferência de embriões de mosaico 2021. Reprod Biomed Online.
Leigh D, Cram DS, Rechitsky S, Handyside A, Wells D, Munne S, Kahraman S, Grifo J, Katz-Jaffe M, Rubio C et al. Declaração de posição do PGDIS sobre a transferência de embriões de mosaico 2021. Reprod Biomed Online. 2022.
Levy B, Hoffmann ER, McCoy RC, Grati FR. Mosaicismo cromossômico: Origens e implicações clínicas na pré-implantação e diagnóstico pré-natal. Diagn pré-dia. 2021; 41: 631-641.
Martín Á, Rodrigo L, Beltrán D, Meseguer M, Rubio C, Mercader A, de Los Santos MJ. A assinatura morfocíntica dos embriões de mosaico: evidências em apoio à sua própria identidade genética. Estéril Fértil. 2021; 116: 165-173.
Mourad A, Antaki R, Bissonnette F, Al Baini O, Saadeh B, Jamal W. Priorização clínica baseada em evidências de embriões com resultados de mosaico: revisão sistemática e meta-análise. J Assist Reprod Genet. 2021; 38: 2849-2860.
Munné S, Wells D. Detecção de mosaico em estágio blastocisto com o uso de sequenciamento de alta resolução de próxima geração. Estéril Fértil. 2017; 107: 1085-1091.
Navratil R, Horak J, Hornak M, Kubicek D, Balcova M, Tauwinklova G, Travnik P, Vesela K. Concordância de vários erros cromossômicos entre diferentes partes do embrião e o valor da rebiópsia em embriões com aneuploidies segmentais. Mol Hum Reprod. 2020; 26: 269-276.
Patrizio P, Shoham G, Shoham Z, Leong M, Barad DH, Gleicher N. Nascidos vivos em todo o mundo após a transferência de embriões cromossomicamente “anormais” após o PGT/A: resultados de uma pesquisa mundial baseada na web. J Assist Reprod Genet. 2019; 36: 1599-1607.
Popovic M, Dhaenens L, Taelman J, Dheedene A, Bialecka M, De Sutter P, Chuva de Sousa Lopes SM, Menten B, Heindryckx B. Cultura in vitro estendida de embriões humanos demonstra a natureza complexa de diagnosticar mosaico cromossômico a partir de uma biópsia de trophectodoma. Hum Reprod. 2019; 34: 758-769.
Popovic M, Dheedene A, Christodoulou C, Taelman J, Dhaenens L, Van Nieuwerburgh F, Deforce D, Van den Abbeel E, De Sutter P, Menten B et al. Mosaico cromossômico em blastocistos humanos: o desafio final dos testes genéticos de pré-implantação? Hum Reprod. 2018; 33: 1342-1354.
Comitê de Prática e Grupo Profissional de Aconselhamento Genético (GCPG) da ASRM. O manejo clínico do mosaico resulta de testes genéticos de pré-implantação para aneuploidia (PGT-A) de blastocistos: um parecer do comitê. Estéril Fértil. 2020; 114: 246-254.
PRÉ-IMPLANTAÇÃO DE DIAGNÓSTICO GENÉTICO SOCIEDADE INTERNACIONAL. DECLARAÇÃO DE POSIÇÃO DA PGDIS SOBRE A TRANSFERÊNCIA DE EMBRIÕES MOSAICO 2021. http://pgdisorg/pgd_positionhtml. 2021.
Sachdev NM, McCulloh DH, Kramer Y, Keefe D, Grifo JA. A reprodutibilidade de biópsias de tropectoderma em embriões euploides, aneuploides e mosaicos usando sequenciamento de última geração verificado independentemente (NGS): um estudo piloto. J Assist Reprod Genet. 2020; 37: 559-571.
Shahbazi MN, Wang T, Tao X, Weatherbee BAT, Sun L, Zhan Y, Keller L, Smith GD, Pellicer A, Scott RT, Jr. et al. Potencial de desenvolvimento de embriões humanos aneuploides cultivados além da implantação. Nat Commun. 2020; 11: 3987.
Spinella F, Fiorentino F, Biricik A, Bono S, Ruberti A, Cotroneo E, Baldi M, Cursio E, Minasi MG, Greco E. A extensão do mosaico cromossômico influencia o resultado clínico dos tratamentos de fertilização in vitro. Estéril Fértil. 2018; 109: 77-83.
Theobald R, SenGupta S, Harper J. O status de teste genético de pré-implantação no Reino Unido e nos EUA. Hum Reprod. 2020; 35: 986-998.
van Montfoort A, Carvalho F, Coonen E, Kokkali G, Moutou C, Rubio C, Goossens V, De Rycke M. ESHRE PGT Consortium coleção XIX-XX: Análises pgt de 2016 a 2017 (†). Hum Reprod Open. 2021; 2021: hoab024.
Verdyck P, Berckmoes V, Van Laere S, Keymolen K, Olsen C, De Rycke M. Análise da contribuição parental para detecção de aneuploidia (APCAD): um novo método para detectar aneuploidia e mosaico em embriões pré-implantação. Reprod Biomed Online. 2021.
Vermeesch JR, Voet T, Devriendt K. Diagnóstico genético pré-natal e pré-implantação. Nat Rev Genet. 2016; 17: 643-656.
Vermeulen N, Le Clef N, Veleva Z, D’Angelo A, Tilleman K. Recomendações Europeias para boas práticas, além de um programa de diretrizes baseado em evidências: lógica e método de desenvolvimento. BMJ Evid Based Med. 2019; 24: 30-34.
Victor AR, Tyndall JC, Brake AJ, Lepkowsky LT, Murphy AE, Griffin DK, McCoy RC, Barnes FL, Zouves CG, Viotti M. Cem embriões de mosaico transferidos prospectivamente em uma única clínica: explorando quando e por que resultam em gravidez saudável. Estéril Fértil. 2019; 111: 280-293.
Viotti M. 14. TRANSFERÊNCIAS DE EMBRIÕES MOSAICO — UMA ANÁLISE COMPILADA DOS DADOS PUBLICADOS. Reprod Biomed Online. 2019; 39, Suplemento 1: e23.
Viotti M. Preimplantation Genetic Testing for Chromosomal Abnormalities: Aneuploidy, Mosaicism, and Structural Rearrangements. Genes (Basileia). 2020; 11 anos.
Viotti M, McCoy RC, Griffin DK, Spinella F, Greco E, Madjunkov M, Madjunkova S, Librach CL, Victor AR, Barnes FL et al. Deixe os dados falarem: a necessidade de considerar o mosaico durante a seleção de embriões. Estéril Fértil. 2021a; 116: 1212-1219.
Viotti M, Victor AR, Barnes FL, Zouves CG, Besser AG, Grifo JA, Cheng EH, Lee MS, Horcajadas JA, Corti L et al. Usando dados de resultados de mil transferências de embriões de mosaico para formular um sistema de classificação de embriões para uso clínico. Estéril Fértil. 2021b.
Wu L, Jin L, Chen W, Liu JM, Hu J, Yu Q, Ren XL, Huang B, He H. A verdadeira incidência de mosaico cromossômico após o teste genético de pré-implantação é muito menor do que a indicada pela biópsia do trophectoderm. Hum Reprod. 2021.
Yang M, Rito T, Metzger J, Naftaly J, Soman R, Hu J, Albertini DF, Barad DH, Brivanlou AH, Gleicher N. Esgotamento de células aneuploides em embriões humanos e gastruloides. Nat Cell Biol. 2021; 23: 314-321.
Zahn H, Steif A, Laks E, Eirew P, VanInsberghe M, Shah SP, Aparicio S, Hansen CL. Scalable whole-genoma whole-cell library preparation without preamplification. Métodos Nat. 2017; 14: 167-173.
Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, de Mouzon J, Sokol R, Rienzi L, Sunde A, Schmidt L, Cooke ID et al. O Glossário Internacional sobre Cuidados com Infertilidade e Fertilidade, 2017. Hum Reprod. 2017; 32: 1786-1801 e Estéril Fértil 2017;1108: 1393-1406.
Zhang X, Yang J, Han W, Li C, Huang G. Blastomere movimento correlaciona-se com ploidy e mosaico em embriões humanos em estágio inicial após fertilização in vitro. O Zygote. 2021: 1-15.
Zhang YX, Chen JJ, Nabu S, Yeung QSY, Li Y, Tan JH, Suksalak W, Chanchamroen S, Quangkananurug W, Wong PS et al. O Resultado da Gravidez da Transferência de Embriões de Mosaico: Um Estudo Multicêntrico Prospectivo e Meta-Análise. Genes (Basileia). 2020; 11 anos.