POSICIONAMENTO DA SOCIEDADE AMERICANA DE MEDICINA REPRODUTIVA – ASRM
Em boletim publicado no dia 27 de janeiro de 2021, a ASRM apoia a vacinação em mulheres que estão pensando em engravidar e em mulheres grávidas para minimizar os riscos para si mesmas e sua gravidez.
POSICIONAMENTO DA SOCIEDADE EUROPEIA DE REPRODUÇÃO HUMANA E EMBRIOLOGIA – ESHRE
Em documento emitido no dia 12 de janeiro de 2021, a ESHRE:
- ESHRE recomenda que homens e mulheres tenham acesso aos serviços de fertilidade, e tal acesso não deve depender da disponibilidade de vacinas COVID-19 ou da decisão individual dos pacientes, sobre a vacinação.
- Em homens e mulheres que receberam a vacina, é prudente adiar os tratamentos de reprodução assistida por pelo menos alguns dias, após a conclusão da vacinação.
- A decisão sobre o uso da vacina em mulheres grávidas deve ser tomada em uma consulta conjunto com um profissional de saúde, após considerar os benefícios e riscos.
- Atualmente não há informações sobre a imunidade desenvolvida em pacientes que tiveram a doença COVID-19, após a vacinação.
- ESHRE recomenda monitorar os resultados dos tratamentos de reprodução assistida e compará-los em pacientes vacinados e não vacinados.
- ESHRE pede que os fabricantes de vacinas COVID-19 compartilhem todas as informações e recomendações relevantes sobre vacinação em mulheres grávidas e casais que pretendem engravidar.
- Nesta fase, não há informações sobre a segurança dos diferentes tipos de vacinas durante o atendimento, tratamento de reprodução ou gravidez, e nenhuma recomendação pode ser feita sobre qual é o mais seguro para homens e mulheres que desejam tentar engravidar.
Ainda, em declaração conjunta feita pela Federação Internacional das Sociedades de Fertilidade e ESHRE, em 9 de fevereiro de 2021, mais de 100 vacinas estão em várias fases de desenvolvimento. Para o desenvolvimento das vacinas, há uma ampla variedade de tecnologias que estão sendo aplicadas, como por exemplo o uso de vetores de adenovírus (Oxford-AstraZeneca, Johnson & Johnson e Sputnik V, Gamaleja), RNA mensageiro encapsulado em nanopartículas de lipídeos (Pfizer-BioNTech e Moderna) e o vírus SARS-CoV-2 inativado (Pfizer-BioNTech e Moderna). Nenhuma das vacinas foi produzida com o vírus vivo atenuado (como vacinas contra rubéola, rubéola, varicela e caxumba) que são contraindicados na gravidez, mas o perfil de segurança para mulheres grávidas das vacinas SARS-CoV-2 em desenvolvimento é desconhecido para qualquer uma delas. Enquanto não há relatos dos riscos e efeitos da vacina em mulheres grávidas e que estão amamentando, aguarda-se o término dos estudos clínicos para averiguar a segurança dessas vacinas.
Mulheres que planejam engravidar, mas ainda não estão grávidas, têm as seguintes opções:
- Adiar a gravidez até que as medidas para mitigar efetivamente o risco de pandemia sejam realizadas (ou seja, transmissão de vírus substancialmente reduzida ou disponibilidade de vacinas e pronto acesso ao pré-natal). Em áreas com controle ineficaz da pandemia e recursos atuais limitados para vacinação, esta pode representar uma melhor opção.
- Prosseguir com a concepção, continuar com as medidas de mitigação e procurar pela vacina do COVID-19 o mais rápido possível. Preocupações com relação à capacidade da infraestrutura dos locais de saúde (hospitais/clínicas) em fornecer acesso aos cuidados pré-natais e de parto quanto aos recursos de cuidados críticos também devem ser gerenciados para o manejo de pacientes com infecções graves por coronavírus ao se fazer as recomendações.
Cada escolha oferece potenciais benefícios e riscos. A primeira opção pode representar o risco mínimo, mas pode não ser a melhor opção para mulheres com um período reprodutivo mais curto. A segunda opção pode ser realizada se a paciente decidir que os benefícios potenciais de prosseguir com a vacinação superam os riscos de infecção do COVID-19 citados.
As mulheres que estão grávidas enfrentam as seguintes opções:
- Continuar todas as estratégias de mitigação estabelecidas e adiar a vacinação COVID-19 até depois da gravidez.
- Buscar uma vacina COVID-19 o mais rápido possível e continuar estabelecendo estratégias de mitigação, incluindo distanciamento social, uso de máscaras e lavagem das mãos.
A questão da administração da vacina COVID-19 na gravidez é atualmente o tópico mais contencioso. Várias organizações profissionais ofereceram orientações que tem variado desde um forte endosso de mulheres grávidas recebendo vacinação a uma postura mais cautelosa. A vacinação COVID-19 está sendo oferecida para mulheres grávidas com alto risco de infecção (por exemplo, principalmente profissionais de saúde) em alguns países, como os EUA, mas as recomendações universais ainda não emergiram. No entanto, no início de 2021, está surgindo uma tendência em que mais agências de serviços e sociedades profissionais estão propondo que assim que disponível, sejam oferecidas vacinas às mulheres grávidas. Estratégias de priorização foram recomendadas para mulheres consideradas “extremamente vulneráveis” pelo Comitê Conjunto de Vacinação e Imunização do Reino Unido. Outros indivíduos que merecem consideração especial incluem profissionais de saúde da linha de frente e outros com alto risco de exposição ocupacional e aqueles com comorbidades significativas como doença respiratória, cardiovascular ou renal; diabetes, obesidade ou hipertensão. Reconhecendo que as mulheres grávidas constituem um grupo de alto risco, mas não foram identificados como um grupo de alta prioridade para vacinas, há apelos recentes para a inclusão desse perfil nos estudos de pesquisa.
A decisão de receber ou recusar a vacina depende do risco individual, da disponibilidade da vacina, e as preocupações das pacientes em relação aos riscos desconhecidos das novas vacinas. O aconselhamento profissional é fortemente recomendado tanto para mulheres grávidas quanto para aquelas que planejam conceber.
POSICIONAMENTO DA SOCIEDADE BRASILEIRA DE REPRODUÇÃO ASSISTIDA – SBRA
A SBRA, a Red Latinoamericana de Reproducción Asistida – REDLARA e outras sociedades médicas da América Latina emitiram no dia 02 de fevereiro de 2021 uma nota com o posicionamento das entidades sobre a segurança das doses e a importância da imunização para evitar a doença.
O documento afirma que a vacinação tem efetividade e não induz a risco aumentado de contrair COVID-19.
As sociedades científicas orientam que indivíduos vulneráveis, que apresentam alto risco de infecção e/ou morbidade por COVID-19 – a exemplo das grávidas, os profissionais de saúde e outros que atuam na linha de frente, com maior risco de exposição –, devem ser vacinados. “Não receber a vacina supera o risco de ser vacinado, previamente ou durante a gravidez”, advertem.
Em relação às mulheres que estão tentando engravidar – de forma natural ou por meio de tratamentos de reprodução assistida –, as entidades avaliam que “não há razão para atrasar as tentativas de gravidez ou tratamentos de reprodução assistida se a vacina não estiver disponível ou em caso de pacientes fora de grupos de risco”, orientam.
O posicionamento também adverte que as decisões sobre a utilização (ou não) das vacinas “devem ser compartilhadas entre pacientes e médicos, respeitando-se os princípios éticos da autonomia, beneficência e não maleficência”. O material ressalta ainda que “a informação sobre vacinas deve ser incluída como um item específico em um consentimento informado já existente”.
ANVISA
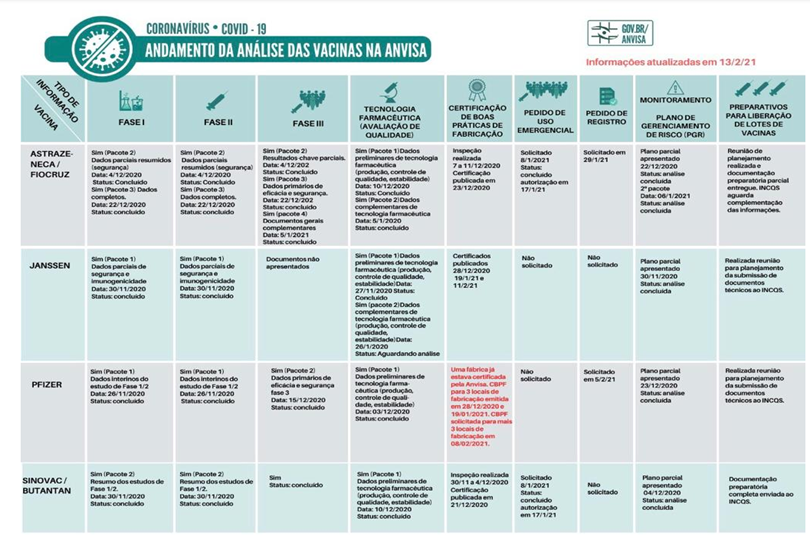
Como observado na tabela abaixo, as vacinas que foram autorizadas de uso emergencial no Brasil foram: AstraZeneca e Sinovac. A Pfizer solicitou o registro definitivo de vacina, que recebeu o nome de Comirnaty, no dia 05 de fevereiro de 2021.
Vale lembrar que a vacina CoronaVac é desenvolvida pela farmacêutica Sinovac, em parceria com o Instituto Butantan, e o imunizante Covishield é produzido pela farmacêutica Serum Institute of India, em parceria com a AstraZeneca/Universidade de Oxford/Fiocruz.
A indústria farmacêutica União Química, que tem acordo com o governo russo para produzir a vacina Sputnik V no Brasil não enviou os documentos básicos para avaliação da ANVISA, como os resultados dos estudos clínicos da fase três, dados sobre a segurança e eficácia do produto.
UNIVERSIDADE DE OXFORD/ASTRAZENECA
Posologia Aprovada:
A vacina contra COVID-19 da Universidade de Oxford/AstraZeneca é uma suspensão para injeção intramuscular administrada em uma sequência de 2 doses de 0,5 mL com intervalo de 4 a 12 semanas após a primeira dose.
O processo de fabricação desta vacina foi desenvolvido na Universidade de Oxford, no Reino Unido, juntamente com a empresa AstraZeneca (AZ). Através de um acordo de transferência de tecnologia, a empresa Serum Institute of India PvT. Ltd. (SIIPL), localizada na Índia, internalizou todas as etapas de fabricação, e é a fabricante da vacina COVID-19 (recombinante) avaliada para o uso emergencial solicitado.
Perfil de segurança em gestantes e lactantes:
Não há informações, uma vez que todos os estudos clínicos excluíram mulheres grávidas e lactantes, portanto, ainda é necessário obter dados sobre segurança a eficácia da vacina nessa população.
Prazo de validade:
6 meses, armazenado a +2ºC e +8ºC. Após aberto, a estabilidade em uso do produto é de no máximo 6 horas a uma temperatura de +2ºC a +8ºC.
Caráter:
Aprovado pela ANVISA para uso emergencial.
SINOVAC/BUTANTAN
Posologia aprovada:
A vacina contra COVID-19 da Sinovac/Butantan é uma suspensão para injeção intramuscular administrada em uma sequência de 2 doses de 0,5 mL com intervalo de 2 – 4 semanas entres as doses. Ainda não foi determinado se doses de reforço do produto serão necessárias.
Perfil de segurança em gestantes e lactantes:
Não existem dados sobre o uso em gestantes e lactantes uma vez que este grupo foi excluído dos ensaios clínicos, portanto, ainda é necessário obter dados sobre a segurança e eficácia da vacina nessa população.
Prazo de validade:
12 meses a partir da data de fabricação. Deve ser armazenada e transportada sob refrigeração, entre +2ºC e +8ºC, protegida da luz. A vacina não deve ser congelada.
Caráter:
Aprovado pela ANVISA para uso emergencial.
SPUTNIK V
Não está aprovada até o momento dessa publicação.
Em um publicação feita no dia 16 de fevereiro de 2021 pela Folha de São Paulo diz que “…a aquisição da vacina Sputnik V contra a COVID-19, apresentada como parte dos planos do Ministério da Saúde para imunizar toda a população, ainda é vista como distante pela Anvisa…”. A agência afirma que faltavam os estudos clínicos de fase 3, com dados de segurança e eficácia do produto para a autorização de uso emergencial da vacina desenvolvida pelo Instituto Gamaleya, da Rússia, assim como para permitir a produção no Brasil.
FDA
A Agência de Administração de Alimentos e Medicamentos dos Estados Unidos (Food and Drug Administration, FDA) emitiu uma Autorização de Uso Emergencial para permitir o uso emergencial do produto não aprovado, vacina contra COVID-19 da Moderna e Pfizer/Biontech, para imunização ativa a fim de prevenir a doença causada pelo coronavírus 2019 (Coronavirus Disease 2019, COVID-19) em pessoas com 18 anos de idade ou mais.
MODERNA
Posologia aprovada:
A vacina contra COVID-19 da Moderna é uma suspensão para injeção intramuscular administrada em uma sequência de 2 doses de 0,5 mL com intervalo de 1 mês entre as doses. Ainda não foi determinado se doses de reforço do produto serão necessárias.
Perfil de segurança em mulheres grávidas e lactantes:
Os dados disponíveis sobre a vacina contra COVID-19 da Moderna administrada a gestantes e lactantes não são suficientes para informar os riscos associados à vacina na gravidez.
Prazo de validade e armazenamento:
Os frascos-ampolas de dose múltipla da vacina contra COVID-19 da Moderna são armazenados congelados, entre -25° e -15°C. Não deve ser armazenado em gelo seco ou abaixo de -40°C. Os frascos-ampolas podem ser armazenados em refrigerador entre 2° e 8°C por até 30 dias antes do primeiro uso. Após o descongelamento, não poderá ser congelado novamente.
Caráter:
Aprovado para uso emergencial nos EUA.
PFIZER-BIONTECH
Posologia aprovada:
A vacina contra COVID-19 da Pfizer-BioNTech é uma suspensão para injeção intramuscular administrada em uma sequência de 2 doses intercaladas no intervalo de 3 semanas. A duração da proteção contra COVID-19 é desconhecida atualmente.
Perfil de segurança em mulheres grávidas e lactantes:
Os dados disponíveis sobre a vacina contra COVID-19 da Pfizer-BioNTech administrada a gestantes e lactantes não são suficientes para informar os riscos associados à vacina na gravidez.
Prazo de validade e armazenamento:
A vacina deve ser armazenada a temperatura -75º C (±15) por até 6 meses. Para possibilitar o transporte aos diferentes países ou locais de aplicação, a Pfizer desenvolveu uma embalagem com potencial de armazenamento na temperatura necessária a base de gelo seco. Nesta embalagem, os frascos de vacina podem ser mantidos por até 30 dias, desde que a correta manutenção do gelo seco seja realizada. A vacina pode ainda ser mantida no refrigerador comum por até 5 dias.
Caráter:
Aprovado para uso emergencial nos EUA e enviado o pedido de registro definitivo à ANVISA.
OMS
No site da Organização Mundial da Saúde (World Health Organization – WHO), o grupo consultivo estratégico de especialistas em imunização da OMS emitiu algumas recomendações para o uso das vacinas da Universidade de Oxford/AstraZeneca, Moderna e Pfizer/Biontech para mulheres grávidas. Veja abaixo:
UNIVERSIDADE DE OXFORD/ASTRAZENECA
Em uma publicação feita no dia 11 de fevereiro de 2021, a OMS declara que:
“…Embora a gravidez coloque as mulheres em maior risco de COVID-19 grave, poucos dados estão disponíveis para avaliar a segurança da vacina na gravidez. Mulheres grávidas podem receber a vacina se o benefício da vacinação de uma mulher grávida superar os riscos potenciais da vacina. Por esta razão, mulheres grávidas com alto risco de exposição ao SARS-CoV-2 (por exemplo, profissionais de saúde) ou que tenham comorbidades que aumentam o risco de doença grave, podem ser vacinadas em consulta com seu médico…”
SINOVAC/BUTANTAN
Não foi encontrado nenhuma nota no site da OMS referente a vacina Sinovac/Butantan.
MODERNA
Em uma publicação feita no dia 26 de janeiro de 2021, a OMS declarou que:
“ …. Embora a gravidez coloque as mulheres em maior risco de COVID-19 grave, poucos dados estão disponíveis para avaliar a segurança da vacina na gravidez. No entanto, com base no que sabemos sobre este tipo de vacina, não temos nenhuma razão específica para acreditar que haverá riscos específicos que superariam os benefícios da vacinação para mulheres grávidas. Por esta razão, as mulheres grávidas com alto risco de exposição ao SARS-CoV-2 (por exemplo, profissionais de saúde) ou que tenham comorbidades que aumentam o risco de doença grave, podem ser vacinadas em consulta com seu médico…”
PFIZER/BIONTECH
Em nota publicada no dia 8 de janeiro de 2021, a OMS declarou em seu site que:
“… mulheres grávidas correm maior risco de COVID-19 grave do que mulheres não grávidas, e COVID-19 foi associado a um risco aumentado de parto prematuro. No entanto, devido a dados insuficientes, a OMS não recomenda a vacinação de gestantes neste momento. No caso de uma gestante ter um alto risco inevitável de exposição (por exemplo, uma profissional de saúde), a vacinação pode ser considerada em discussão com seu médico. Se uma mulher que amamenta faz parte de um grupo (por exemplo, profissionais de saúde) recomendado para vacinação, a vacinação pode ser oferecida. A OMS não recomenda a interrupção da amamentação após a vacinação …”
 Rhayza R. Andretta, PhD – Scientific Adviser & CRA
Rhayza R. Andretta, PhD – Scientific Adviser & CRA
Referências
ANVISA: Covid-19: quadro de análises de vacinas pela Anvisa. Disponível em:
ANVISA – Universidade de Oxford/Astrazeneca – Parecer Público de avaliação de solicitação de autorização temporária de uso emergencial, em caráter experimental, da vacina covid-19 (recombinante) – Fundação Oswaldo Cruz (Fiocruz). Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/vacinas-uso-emergencial
ANVISA- SINOVAC/Butantan – Parecer Público de avaliação de solicitação de autorização temporária de uso emergencial, em caráter experimental, da vacina adsorvida covid-19 (inativada) – Instituto Butantan. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/vacinas-uso-emergencial
ASRM Bulletin: American Society for Reproductive Medicine (ASRM) Position on COVID Vaccine Use in Pregnant Women. Disponível em: https://www.asrm.org/news-and-publications/news-and-research/press-releases-and-bulletins/american-society-for-reproductive-medicine-asrm-position-on-covid-vaccine-use-in-pregnant-women/
ESHRE- Joint IFFS/ ESHRE statement on COVID-19 vaccination for pregnant women and those considering pregnancy. Disponível em: https://www.eshre.eu/Europe/Position-statements/COVID19/JointESHRE_IFFSvaccination
ESHRE – COVID-19 vaccination and assisted reproduction. Disponível em: https://www.eshre.eu/Home/COVID19WG
FDA – Moderna – Fact sheet for recipients and care givers emergency use authorization (EUA) of the Moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19) in individuals 18 years of age and older. Disponível em: https://www.fda.gov/media/144638/download
FDA – Moderna – Vaccines and Related Biological Products Advisory Committee. Disponível em: https://www.fda.gov/media/144452/download
FDA – Pfizer – Vaccines and Related Biological Products Advisory Committee. Disponível em: https://www.fda.gov/media/144245/download
FDA – Pfizer – Fact sheet for healthcare providers administering vaccine (vaccination providers). Disponível em: https://www.fda.gov/media/144413/download
OMS – The Oxford/AstraZeneca COVID-19 vaccine: what you need to know. Disponível em: https://www.who.int/news-room/feature-stories/detail/the-oxford-astrazeneca-covid-19-vaccine-what-you-need-to-know
OMS – Who can take the Pfizer-BioNTech COVID-19 vaccine? Disponível em: https://www.who.int/news-room/feature-stories/detail/who-can-take-the-pfizer-biontech-covid-19–vaccine
OMS – The Moderna COVID-19 (mRNA-1273) vaccine: what you need to know. Disponível em:
https://www.who.int/news-room/feature-stories/detail/the-moderna-covid-19-mrna-1273-vaccine-what-you-need-to-know#:~:text=The%20WHO%20Strategic%20Advisory%20Group,aged%2018%20years%20and%20older.
Pfizer Press Release. An Open Letter from Pfizer Chairman and CEO Albert Bourla. Disponível em: https://www.pfizer.com/news/hot-topics/an_open_letter_from_pfizer_chairman_and_ceo_albert_bourla.
Pfizer Press Release: “BioNTech and Pfizer Initiate Rolling Submission to European Medicines Agency for SARS-CoV-2 Vaccine Candidate BNT162b2”. Disponível em: https://www.pfizer.com/news/press-release/press-release-detail/biontech-and-pfizer-initiate-rolling-submission-european.
SBRA- SARS-CoV-2 (Covid-19): vacinas, reprodução assistida e grávidas – Posição atual conjunta. Disponível em: https://sbra.com.br/wp-content/uploads/2021/02/SARS-Cov-TRADUÇÃO-1-1.pdf
SPUTNIK V – Lobby pró-Sputnik trava, e União Química enfrenta resistência a uso emergencial e produção de vacina. Disponível em: https://www1.folha.uol.com.br/equilibrioesaude/2021/02/lobby-pro-sputnik-trava-e-uniao-quimica-enfrenta-resistencia-a-uso-emergencial-e-producao-de-vacina.shtml?origin=folha